Hidrogenul, H
Tag-uri
Partajeaza in Google Classroom
Scurtă definiție
Definiție Descarcă PDF
Acțiunea vaporilor de apă asupra fierului încălzit la roșu
Prin electroliza apei
Prin disocierea termică a unor hidrocarburi
Din gazele de cocserie
Caracteristici generale
Hidrogenul este primul element din tabelul periodic. Hidrogenul are atomul format din nucleu (unde se găsește un proton) și un singur electron în stratul n=1. Configurația electronică a atomului de hidrogen este 1s1.
Datorită proprietăților lui, hidrogenul se apropie de elementele grupei a VII-a principale, dar și într-o măsură de proprietățile elementelor grupei I principale. Într-adevăr, la hidrogen se pot observa două tendințe:
a) Tendința de a accepta un electron, pentru a dobândi configurația atomului de heliu:
Aceasta este formarea ionului de hidrură, H-.
Afinitatea pentru electron este mică (0,715 eV). Ionul de hidrură, H-, apare în hidrurile metalelor alcaline și alcalino-pământoase, combinații care, ca și combinațiile acestor metale cu halogenii, au caracter de sare, hidrogenul fiind componenta electronegativă.
b) Tendința de a ceda electronul, trecând într-un ion pozitiv, un proton:
Aceasta este formarea ionului de hidrogen sau a protonului H+.
Ionul pozitiv de hidrogen fiind un nucleu fără electroni, posedă un volum incomparabil mai mic decât alți ioni pozitivi. Diametrul protonului este 0,00001 Å, pe când cel al altor ioni pozitivi variază între 0,2 și 3,3 Å. Prin aceasta, hidrogenul se deosebește de toate celelalte elemente.
Protonul în stare liberă nu apare în nicio reacție chimică. Potențialul de ionizare al atomului de hidrogen fiind foarte mare (13,5 eV), nu există reacție chimică în care se poate degaja suficientă energie pentru ionizarea atomului de hidrogen. De aceea, ionul de hidrogen există numai legat coordinativ de alte molecule. Așa, de exemplu, se leagă de atomul de oxigen din molecula de apă, formând un ion de hidroniu, H3O+:
Hidrogenul manifestă și tendința de a se lega covalent:
În această formă, legat covalent, hidrogenul se găsește legat de majoritatea nemetalelor: NH3, H2O, H2S, HCl, CH4, etc.
De asemenea, trebuie amintită proprietatea hidrogenului de a forma legături (punți) de hidrogen.
Răspândirea în natură
În stare liberă, hidrogenul este foarte puțin răspândit în natură; în atmosferă, în apropierea pământului, se găsește doar sub formă de urme (5 x 10-5 %). Uneori se mai găsește în amestec cu alte gaze, în emanațiile vulcanice. S-au identificat cantități mari de hidrogen în jurul soarelului și al altor aștri. Sub formă combinată, hidrogenul este însă foarte răspândit în natură, el fiind componenta apei și a majorității compușilor organici.
Preparare
În laborator, hidrogenul se obține din diferite combinații prin reacții de substituție cu un metal. Aceasta este reacția generală:
a) Obținerea hidrogenului din acizi: notând acidul sub forma generală HR, reacția este:
Ca acid se folosesc acidul clorhidric sau acidul sulfuric diluat, iar ca metal, zincul sau fierul:
Prepararea se face de obicei în aparatul Kipp.
Acțiunea acestor metale asupra apei este atât de energică încât hidrogenul care se formează se aprinde din cauza temperaturii ridicate și arde cu flacără colorată în galben - în cazul sodiului, și în violet - în cazul potasiului.
Și alte metale reacționează cu apa cu formare de hidrogen, dar în condiții diferite de temperatură, în funcție de reactivitatea metalului. De exemplu, cu magneziu, reacția începe de la 70°C.
c) Obținerea hidrogenului din hidruri metalice: Hidrogenul poate fi obținut și prin reacția unei hidruri metalice cu apa, de exemplu reacția hidrurii de calciu cu apa, din care se obține hidrogen și hidroxid de calciu:
Industrial, hidrogenul se prepară prin următoarele metode:
a) Acțiunea vaporilor de apă asupra cărbunelui la temperatură înaltă: Prin trecerea vaporilor de apă peste cărbune (cocs) încălzit, la o temepratură mai mare de 1000°C, se obține un amestec de hidrogen și oxid de carbon, numit gaz de apă:
În timpu reacției se formează și dioxid de carbon:
Hidrogenul poate fi separat din acest amestec, fie prin lichefiere parțială (oxidul de carbon lichefiindu-se la -190°C, hidrogenul rămâne în stare gazoasă), fie trecând gazul de apă în amestec cu vapori de apă peste un catalizator, la temperatură de circa 400°C, când are loc transformarea oxidului de carbon în dioxid de carbon:
care se îndepărtează apoi prin spălare cu apă sub presiune, sau cu leșie alcalină.
Din oxidul de fier format se poate obține din nou fierul, trecând peste oxidul de fier un curent de oxid de carbon (din gaz de apă):
În acest fel, aceeași cantitate de fier poate fi folosită de repetate ori. Metoda a avut în trecut importanță tehnică.
c) Obținerea hidrogenului prin electroliza apei: Procedeul reprezintă o metodă industrială de obținere a hidrogenului concomitent cu obținerea oxigenului. Acest procedeu este economic atunci când există curent electric ieftin (centrale hidroelectrice) și oxigenul rezultat concomitent are întrebuințare. Altfel se preferă obținerea hidrogenului ca produs secundar la electroliza unei soluții de clorură de sodiu (pentru fabricarea sodei caustice), așa cum se obține în fabricile de sodă caustică de la noi din țară.
d) Obținerea hidrogenului prin disocierea termică a unor hidrocarburi: De exemplu, metanul, CH4, trecut peste un catalizator, la temperatura de 1100°C, se descompune în carbon și hidrogen:
Operația se numește cracare. Pentru a împiedica depunerea pe catalizator a carbonului format, metanului i se adaugă vapori de apă; în acest caz rezultă, pe lângă hidrogen, și oxid sau dioxid de carbon, în funcție de cantitatea de apă introdusă:
Oxizii de carbon formați sunt îndepărtați prin diferite metode și hidrogenul rămâne pur.
Acest procedeu este aplicabil în țările unde sunt izvoare bogate de gaze naturale. În România există instalații pentru obținerea hidrogenului prin această metodă.
e) Obținerea hidrogenului din gazele de cocserie: Gazele de cocserie, obținute la distilarea huilei la circa 1000°C, conțin un procent mare de hidrogen (aprximativ 50%). Separarea de celelalte gaze din amestec se poate face prin distilare fracționată la temperaturi joase.
Proprietăți fizice
La temperatură obișnuită, hidrogenul este un gaz fără culoare, fără miros și fără gust. Este cel mai ușor dintre toate gazele, fiind de 14,38 ori mai ușor decât aerul. În apă se dizolvă foarte puțin.
Constantele fizice ale hidrogenului
Punctul de lichefiere: -252,8°C
Punctul de topire: -257,3°C
Conductibilitatea termică (0°C):
Solubilitatea în apă (18°C): 0,0185 vol/1 vol. apă
Căldura de formare a moleculei H2 din atomi (0°K): 102,72 kcal/mol H2
Distanța între nuclee H-H: 0,75 Å
Momentul electric: 0
Potențialul de ionizare: 13,595 eV(*)
Afinitatea pentru electron: 0,715 eV
Electronegativitatea (conform Linus Pauling): 2,1
(*) Pentru determinarea energiei de ionizare, în kcal/mol, se înmulțește valoarea potențialului de ionizare, în eV, cu factorul de transformare 23,053. Pentru hidrogen, energia de ionizare este 313,4 kcal/mol.
Din cauza masei moleculare mici, hidrogenul are cea mai mare putere de difuziune dintre toate gazele; el străbate cu ușurință membrane poroase. La temperatură înaltă, hidrogenul poate difuza prin unele metale ca fierul, platina, precum și prin cuarț. Hidrogenul este caracterizat printr-o deosebită conductibilitate termică și electrică.
Proprietăți chimice
Hidrogenul este puțin reactiv la temperatura obișnuită. În anumite condiții însă, reacționează cu numeroase substanțe simple și compuse.
Combinațiile hidrogenului cu substanțe simple
Hidrogenul se combină direct cu halogenii formând acizi halogenați. Astfel, cu luorul, cel mai electronegativ element, hidrogenul se combină cu explozie formând acid fluorhidric:
Cu clorul, hidrogenul se combină sub influența luminii formând acid clorhidric:
Prin combinarea hidrogenului cu oxigenul se formează apă, reacție însoțită de mare degajare de căldură:
Un amestec de hidrogen și oxigen în proporție volumică H2:O2 de 2:1, aprins cu ajutorul unei scântei electrice sau al unei flăcări, explodează. Un asemenea amestec se numește gaz detonant.
Cu sulful, hidrogenul reacționează încet formând hidrogen sulfurat:
Combinarea hidrogenului cu azotul se produce numai sub presiune și în prezență de catalizator la temperatură medie (500°C):
Unele metale se combină, de asemenea, direct cu hidrogenul; de exemplu metalele alcaline:
Combinațiile binare ale hidrogenului se numesc hidruri. Există trei categorii de hidruri:
- Cu elementele din grupele principale VII, VI, V, IV și unele elemente din grupa a III-a ale sistemului periodic, hidrogenul formează hidruri volatile (vezi mai jos, Tabel Hidruri). În aceste combinații hidrogenul este legat covalent. Energia de combinare a hidrogenului în hidrurile volatile variază după natura elementului. În general, în fiecare grupă combinarea elementelor cu hidrogenul se face cu atât mai greu, cu cât masa lor atomică este mai mare.
- Cu metalele din grupele I și II principale din sistemul periodic, hidrogenul formează hidruri cu caracter de sare, hidruri ionice, în care hidrogenul formează componentul negativ (ionul de hidrură, H-). La electroliza hidrurilor ionice topite, hidrogenul se degajă la anod. Hidrurile unor elemente din grupele II și III principale se găsesc ușor sub formă de asociații de molecule formate prin punți de hidrogen (hidruri polimere).
- Cu metalele din grupele secundare ale sistemului periodic, hidrogenul formează hidruri interstițiale, în care nu au întotdeauna o compoziție stoechiometrică.
| I | II | III | IV | V | VI | VII |
|---|---|---|---|---|---|---|
| LiH | [BeH2]x | (BH3)2 | CH4 | NH3 | OH2 | FH |
| NaH | [MgH2]x | [AlH3]x | SiH4 | PH3 | SH2 | ClH |
| KH | CaH2 | (GaH3)2 | GeH4 | AsH3 | SeH2 | BrH |
| RbH | SrH2 | [InH3]x | SnH4 | SbH3 | TeH2 | IH |
| CsH | BaH2 | TlH3 | PbH4 | BiH3 | PoH2 | AtH |
Stabilitatea crește de jos în sus, pe coloană
Hidrurile ionice (saline) sunt îngroșate; hidrurile covalente (volatile) sunt subliniate.
Reducerea oxizilor
Afinitatea deosebit de intensă a hidrogenului față de elementele puternic electronegative (F, Cl, O, S) determină acțiunea reducătoare pe care hidrogenul o exercită asupra combinațiilor acestor elemente. Astfel, aproape toți oxizii metalici pot fi reduși de hidrogen până la metalul respectiv, condițiile de temperatură și presiune variind de la caz la caz. Cu cât oxizii sunt mai puțin stabili (au căldură de formare mai mică) cu atât sunt mai ușor reduși de hidrogen. De aceea, oxizii metalelor care urmează după hidrogen în seria tensiunilor electrochimice (a căror căldură de formare este mai mică decât căldura de formare a apei), ca de exemplu Ag2O, HgO, CuO, pot fi reduși de hidrogen:
Ortohidrogenul și parahidrogenul
Hidrogenul molecular obișnuit este un amestec de trei părți ortohidrogen și o parte parahidrogen. La temperaturi mai joase, proporția de parahidrogen este mai mare; de aceea, separarea celor două forme se face la temperatură joasă, iar la 20°K, prin absorbția hidrogenului pe cărbune activ, se obține parahidrogen pur.
Ortohidrogenul și parahidrogenul se deosebesc după sensul de rotație al nucleelor în jurul axelor proprii ale celor doi atomi care formează molecula de hidrogen; la ortohidrogen nucleele se rotesc în același sens, iar la parahidrogen în sens opus.
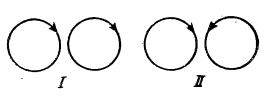
Ortohidrogen (I) și parahidrogen (II)
Ortohidrogenul și parahidrogenul au aceleași proprietăți chimice, dar se deosebesc prin unele proprietăți fizice, cum sunt căldurile specifice și spectrele.
Hidrogenul atomic
Molecula de hidrogen este o moleculă stabilă. Ea nu poate fi disociată decât la temperaturi foarte înalte, reacția fiind puternic endotermă:
\(H_2\rightleftharpoons2H; \: \: \: \Delta H=102,7\:kcal/mol\)
Se poate obține hidrogen puternic disociat în atomi, de exemplu, trecând un curent de hidrogen printr-un arc electric format între doi electrozi de wolfram. Deși viteza de recombinare a atomilor de hidrogen în molecule H2 este foarte mare, totuși existența hidrogenului atomic a fost pusă în evidență. În contact cu un metal, căldura degajată la recombinarea atomilor poate aduce metalul în stare de topire.
Hidrogenul atomic este mai reactiv decât hidrogenul molecular. El are proprietatea să reducă, chiar la temperatura obișnuită, o serie de oxizi metalici (de exemplu CuO, PbO, Bi2O3, HgO, Ag2O), sulfuri și halogenuri; cu sulful, arsenul și fosforul se combină formând hidrurile respective; cu oxigenul molecular, la temperatură mai joasă, formează apă oxigenată.
Întrebuințări
Fiind cel mai ușor dintre toate gazele, una dintre primele întrebuințări ale hidrogenului a fost umplerea baloanelor și dirijabilelor. Astăzi, industria chimică folosește cantități mari de hidrogen, mai ales la fabricarea prin sinteză a amoniacului și a acidului clorhidric.
Hidrogenarea a devenit astăzi o metodă curentă pentru prepararea a numeroase produse noi din materii prime existente. Astfel, benzinele de sinteză se obțin prin acțiunea hidrogenului asupra cărbunilor, gudroanelor, etc. la temperaturi înalte. Uleiurile vegetale supuse hidrogenării (sub presiune și în prezență de catalizatori) se solidifică; asemenea grăsimi solidificate sunt întrebuințate în alimentație (de exemplu, margarina).
Flacăra de hidrogen și oxigen folosește pentru tăierea metalelor chiar sub apă (important pentru construcția podurilor și reparația vapoarelor), precum și la prelucrarea sticlei de cuarț, a platinei și a altor materiale cu punct de topire înalt. Deoarece hidrogenul are o mare putere reducătoare, el este folosit la lipirea metalelor care se oxidează ușor la cald (Pb, Al).
Izotopii hidrogenului
Hidrogenul are trei izotopi:
- izotopul obișnuit, H, numit hidrogen ușor sau protiu, al cărui nucleu, H+, este protonul;
- izotopul
, numit hidrogen greu sau deuteriu,
, al cărui nucleu, D+, este deuteronul;
- izotopul
, numit hidrigen supragreu sau tritiu,
.
Tritiul este prezent în hidrogenul obișnuit în cantități minime, abundența relativă fiind de ordinul 10-17:1. Proveniența lui în natură se atribuie reacției nucleare:
Tritiul este un izotop radioactiv al hidrogenului; prin dezintegrare
Deuteriul există în hidrogenul obișnuit în proporție de 0,02%. El se poate obține prin mai multe metode, mai ales din oxidul de deuteriu prin descompunere cu un metal, sau prin electroliză. Proprietățile deuteriului sunt asemănătoare cu cele ale hidrogenului; constantele fizice sunt însă diferite. De exemplu, punctul de fierbere (H2 = -252,7°C; D2 = -249,5°C), punctul de topire (H2 = -259,2°C; D2 = -254,5°C), precum și tensiunea de vapori, căldurile latente de topire și de evaporare, etc.
Deuteriul reacționează similar hidrogenului formând compuși echivalenți; reacțiile respective se desfășoară însă mai lent. De exemplu, se combină direct cu halogenii și cu azotul.
Descoperirea deuteriului a deschis un capitol important în chimie, și anume acela al substituției izotopice. Într-adevăr, există numeroase substanțe hidrogenate, care în anumite condiții pot schimba atomii de hidrogen cu atomi de deuteriu. Astfel, la temperatură înaltă, deuteriul reacționează cu hidrogenul și formează HD prin schimb izotopic:
Deuteriul poate înlocui hidrogenul din moleculele de CH4, NH3, H2O:
De asemenea, deuteriul poate înlocui hidrogenul din molecula de benzen, C6H6, în prezența negrului de platină:
Nucleul deuteriului, deuteronul, are întrebuințări ca particulă de dezintegrare în reacții nucleare.
Oxidul de deuteriu, D2O, cunoscut sub numele de apă grea, se găsește în cantități foarte mici în apa obișnuită și se obține prin electroliza îndelungată a apei tratate cu hidroxid de sodiu. Întrucât acest proces este legat de un consum foarte mare de energie electrică, mai ales la început, se supune electrolizei o apă îmbogățită în prealabil cu apă grea.
Proprietățile fizice ale apei grele diferă de cele ale apei obișnuite; astfel, apa grea are punctul de solidificare 3,82°C, punctul de fierbere 101,42°C, iar densitatea sa la 20°C este 1,105. Apa grea dizolvă mai greu sărurile, iar reacțiile sunt mai lente decât reacțiile cu apa obișnuită. Apa grea este toxică pentru organismele vii.
Dacă se introduc în apă grea combinații ce conțin hidrogen, atunci acesta înlocuiește deuteriul din apa grea, de exemplu:
În felul acesta s-a înlocuit hidrogenul din molecula de acizi hidrogenați, amoniac, apă oxigenată, apoi hidrogenul din grupele hidroxil ale unor combinații organice (acizi carboxilici, fenoli, alcooli). Astfel de reacții de dublu schimb cu apa grea au folosit la stabilirea naturii legăturii atomilor de hidrogen în diferite molecule; de asemenea au adus lămuriri în unele mecanisme de reacții, precum și în unele probleme biologice. Apa grea este folosită și în reactoare nucleare.
Preambul
Referințe
Edith Beral, Mihai Zapan: Chimie Anorganică, ediția a 3-a, Editura Tehnică, București, 1963






