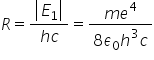Legea seriilor spectrale în modelul Bohr.
Tag-uri
Partajeaza in Google Classroom

Transcript
în cea de a opta lecții de fizică
atomică vom discuta despre spectrele
atomului de hidrogen în lecțiile
trecute am dezvoltată modelul Atomic
a lui bohr și am început să discutăm
despre primele aplicații practice
ale lui Spre exemplu în calculul
energiei de ionizare a atomului
de hidrogen dorind să vedem în
această lecție dacă modelul vor
poate explica rezultatele experimentale
obținute în în studiile asupra
aspectelor atomului de hidrogen
Deci primul lucru pe care dorim
să le reamintim rapid este ceea
ce am discutat în prima lecție
de fizică atomică și anume rezultatele
experimentale în legătură cu aspectele
de emisie atomice care sunt spectrele
de linii ce respectă așa numita
lege a seriilor spectrale Care
este următoarea 1 pe Lambda de
cinci versuri lungimii de undă
a radiației emisă de un atom în
cazul acesta de hidrogen este egal
cu Constanța rydberg care are această
valoare înmulțită cu 1 pe n1 la
pătratul Unde în unul este numărul
serii spectrale minus 1 pe 2 la
pătrat unde N2 este numărul liniei
din seria spectrală respectivă
Deci în doi trebuie să fie mai
mare decât în unu și atunci această
mărime este pozitiv definită am
discutat despre Toate aceste lucruri
și despre seriile spectrale particulare
ce se pot obține în prima lecție
de fizică atomică un comentariu
acestă mărime și anume inversul
lungimii de undă se mai numește
și număr de 1 2 și se notează cu
nu tilda vom introduce în curând
această notație Deci ne propune
un această lecție să vedem dacă
putem explica aceste rezultate
experimentale folosind modelul
bohr În primul rând să reamintim
postulatul al doilea arbore care
spune că o linie din spectrul de
emisie de linii al atomului de
hidrogen corespunde unei frecvențe
de tranziție între două stări staționare
am modificat un pic formularea
dar este însă postulatul lui bohr
este aceasta scrisă matematică
asta înseamnă că frecvența radiației
mi sa vorbim despre aspecte de
emisie în cazul acesta de frecvența
radiației de emisie va fi egală
cu diferența dintre energia stării
staționare inițiale și cea a Stării
staționare finale împărțită la
Constanța planck h folosind legătura
dintre lungimea de undă și frecvent
sunt și anume aici lungimea de
undă a unei radiații este prin
definiție gală cu viteza de propagare
Care este viteza în fiind mulți
viteza luminii în vid înmulțită
cu perioada unde a Deci avem Lambda
egal cu c împărțit la frecvență
Deci înlocuind frecvența cu lungimea
de unde În această formulă obținem
că inversul lungimii de undă emise
de către un atom de hidrogen în
tranziția între o stare inițială
și o stare finală are această valoare
a minus e f împărțit la HC unde
din nou a este energia stării staționare
inițiale și ef este energia stări
staționare finale iar h e f este
energia fotonului emis în această
tranziție atomului modelul bohr
Care este dezvoltat plecat plecând
de la postulatele vor modelul bohr
ne dăm o valoare precisă a acestei
energii și anume În cazul acesta
cele două stări staționare corespund
la două nivele energetice cu numerele
cuantice principale și în acest
caz zici mai exact putem scrie
formulele pentru aceste două energii
și ele sunt următoarele energia
stării staționare inițiale este
e 1 împărțit la n e pătrat unde
n este numărul cu anticipa al al
stării inițiale și respectiv energia
stării staționare finale efpa fie
1 împărțit la n f la pătrat și
unul este energia stării fundamentale
care corespunde numărul cuantic
principal n egal cu 1 și are această
valoare după cum am discutat în
lecțiile trecut deja putem vedea
cât obținem o coincidență a formule
pentru numărul de undă obținute
experimental de se vede că experimental
obținem un număr de unde egal cu
o constantă înmulțită cu diferența
dintre două inverse de pătrate
de numere întregi de acest 1 pe
an 1 la pătrat minus 1 pe 2 la
pătrat aceasta este rezultatul
experimental iar modelul bordești
teoria ne spune că acest invers
de lungime de unda va fi întradevăr
egal cu o contră care vom vedea
imediat Cât este dar înmulțită
cu diferența dintre două invers
de pătrate de numere întregi De
ce intră adevăr putem vedea de
la joacă modelul board scrie foarte
bine rezultatul experimenta Haideți
să vedem mai concret Ce rezultă
din această comparație între teorie
și experiment Deci după cum am
spus introducem așa numit un număr
de undă Care este frecvența nu
canti la deasupra și este egală
cu raportul dintre secvență și
viteza luminii în vid Care este
de asemenea Gal după cum o arătat
cu inversul lungimii de undă Deci
modelul bohr de următoare alege
că numărul de undă este egal este
egal cu valoarea absolută a lui
E unul care este energia stării
fundamentale împărțită la HCM Constanța
planck înmulțită cu viteza luminii
în vid înmulțită cu această diferență
între două inverse de numere cuantice
principale la pătrat mai exact
dacă tranziția Ce duce la emisie
fotonului are loc între nivelul
energetic și nivelul energetic
Enea feniciene Fie numele cuantice
principale corespund bineînțeles
energiilor a e și a f și Deci această
tranziție rezultă în emisie fotonului
cu energia H f atunci avem această
legătură dintre numărul de undă
și numerele cuantice principale
ale celor două energii celor două
nivele cu aceste două energii în
care bineînțeles n este mai mare
decât n f pentru a avea o emisie
dacă e n i ar fi mai mic decât
n f am avea o absorție de un anumit
Foton Deci întradevăr modelul bohr
reproduce legea seriilor spectrale
observat experimental coincidența
între lege experimentală și legea
teoretică sar întâmpla dacă numărul
sau Constanta riedberg care e măsurată
experimental arcul inchide cu acest
Factor Ce rezultă din modelul bohr
Deci dacă ar ar fi egal cu modul
din 1 împărțit la HC atunci am
avea o coincidență un o corespondență
perfectă între lege experimentală
și legea teoretică Și de ce am
putea conclude că seriile spectrale
ale atomului de hidrogen sunt foarte
bine descrisă de către modelul
bohr și întradevăr valoare experimentală
pentru r coincide sau are o valoare
foarte apropiată în ținând cont
de erorile experimentale de valoarea
lui R calculată cu ajutorul modulului
lui bohr prin această formulă modul
din 1 împărțit la HC împreună cu
energia de ionizare a atomului
de hidrogen despre care am discutat
în lecția trecută confirmarea Constantin
riedberg a validat modelul cuantic
al atomului propus de Bor Deci
mai exact după cum am discutat
în lecția trecută se poate măsura
energia de ionizare a atomului
de hidrogen și se poate verifica
dacă ea este egală cu predicția
modelului porcarie este modul din
Euro și întradevăr această coincidență
sau această corespondență dintre
valoarea măsurată experimental
și valoarea calculată Teoretic
are loc de asemeni după consultat
acum Constanța rydberg care se
poate măsura experimental și se
măsoară experimental este egală
cu modul din 1 împărțit la orice
Care este valoarea prezisă Teoretic
de modelul bohr Și de ce aceste
două rezultate au dus la confirmarea
modelului lui bohr Haideți să discutăm
acum despre liniile din seriile
spectrale observate experimental
Deci după cum am văzut modelul
lui bohr Propune o lege care este
în într o corespondență foarte
bună cu legea seriilor spectrale
și Deci numărul de undă este o
constantă Constanța rydberg înmulțită
cu această diferență de inverse
de pătrate de numere cuantice principale
numărul n f Stabilește seria spectrală
după cum am văzut iar în modelul
lui bohr n f este numărul cu Antique
principal al stării finale din
tranziție de asemeni este important
să observăm că o serie spectrală
va avea o limită adică un număr
de undă maxim care corespunde unei
valori ale lui n egal cu infinit
Pentru că dacă n este infinit Deci
tranziția are loc de pe un nivel
foarte înalt aflat Teoretic la
infinit atunci acest factor este
0 și atunci obținem valoarea maximă
a numărului de undă care va fi
Constanța rydberg împărțită la
numărul cuantic principal al stării
finale nf la pătrat gol Haideți
să vedem acum cum pot fi explicate
seriile aspect despre care am discutat
în prima lecție de fizică atomică
și anume liman ballmer passion
și așa mai departe Cum pot fi ele
explicate de către modelul bohr
Păi de ce trebuie să Considerăm
foarte simplu tranziții între nivelele
energetice ale atomului de hidrogen
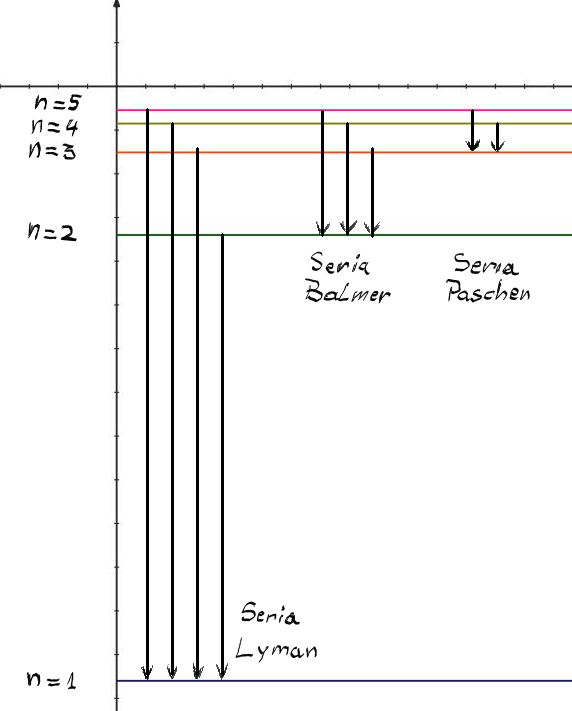
De ce avem nivelul cu An egal cu
unu care este starea fundamentală
stare fundamentală și apoi nivelele
superioare avem un nivel n egal
cu 2 n egal cu 3 consider câteva
nivele pentru a putea reprezenta
apoi tranzițiile între ele n egal
cu patru uși haide să mai luăm
și un an egal cu 5 bineînțeles
ele continuă continuă în principiu
până la n egal cu infinit în funcție
de numărul de nivele pe care vrem
să le consideram după cum am văzut
prima serie spectrală corespunde
unui n f egal cu 1 Deci toate tranzițiile
ce au loc pe starea fundamentală
constituie o serie spectrală iar
această serie spectrală ce corespunde
lui n 1 egal cu 1 și m 2 egal cu
2 3 4 6 mai departe este binecunoscuta
serie leman Deci aceasta este seria
Liman ce apare în domeniul ultraviolet
Deci seria elimin din ultraviolet
care se observă experimental este
formată din toate tranzițiile de
pe stările excitate cu An egal
cu 2 3 4 5 așa mai departe dar
cu starea finală toate au starea
finală n egal cu unu adică starea
fundamental apoi avem seria ballmer
următoarea serie sta ballmer Care
este formată din toate tranzițiile
care au starea finală n egal cu
doi Deci aceste tranziții care
au în unu egal cu doi de numărul
cuantic principal ce corespunde
numărului seriei va fi in 1 egal
cu 2 iar n i sau an doi va fi vor
fi egal cu 3 4 5 și așa mai departe
această Toate aceste tranziții
formează așa numita serie ballmer
seria ballmer care după cum am
văzut experimental are loc în spectrul
vizibil și așa mai departe următoarea
serie passion va avea loc sau va
fi formată din toate tranzițiile
care au ca stare finală starea
in 1 egal cu 3 ești toate tranzițiile
care au loc cu finalitatea tranziții
pe an 1 egal cu 3 vor Formați seria
pași și așa mai departe Deci vedem
întradevăr Cum poate fi explicat
foarte elegant toată pot fi explicate
foarte elegant toate rezultatele
seriilor spectrale ale atomului
de hidrogen dacă vreți putem reprezenta
vizual și altfel aceste tranziții
De ce avem atomul de hidrogen care
are un nucleu În centru nucleul
cu sarcina plus unu și în jurul
lui bineînțeles avem orbitalii
electronici care corespund nivelelor
energetice Deci Să considerăm câteva
foarte schematic De ce am avem
în acest desen nivele energetice
pentru n egal cu 1 an egal cu 2n
egal cu 3 și egal cu 4 atunci seria
ballmer va fi formată din toate
tranzițiile electronilor de pe
nivelele superioare pe nivelul
pe starea fundamentală n egal cu
Deci seria ballmer va fi formată
din aceste tranziții Deci aceasta
este seria balm seria liman va
fi formată din toate tranzițiile
cu starea finală pe prima stare
excitată adică cea cu An egal cu
2 din seria ballmer va fi formată
din tranziții de felul acesta nu
avem numai două în schema noastră
Bineînțeles dacă am fi folosit
și alte nivele energetice cu n
mai mare decât 4 egal cu 5 și mai
departe am fi avut și alte tranziții
în seria seria balmez scuzați prima
serie am făcut o greșeală aici
prima serie este bine înțeles liman
și cea de a doua serie este ballmer
lehman este seria cu starea finală
a n egal cu 1 ballmer este seria
cu starea finală n egal cu 2