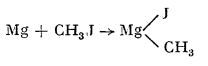Răspândire în natură. Magneziul se găsește mult răspândit în natură sub formă de combinații, alcătuind 2% din scoarța pământului. Astfel se găsește ca zăcăminte de
magnezit (carbonat de magneziu, MgCO
3) și, mai ales, de
dolomit (carbonat dublu de calciu și magneziu, MgCO
3·CaCO
3). Foarte răspândiți sunt și
carnalitul (clorură dublă de potasiu și magneziu, MgCl
2·KCl·6H
2O),
kieseritul (sulfat de magneziu, MgSO
4·H
2O), apoi diferiți silicați de magneziu - ca de exemplu
olivina, (Mg, Fe)
2[SiO
4],
enstatitul Mg
2[Si
2O
6],
serpentina,
talcul,
azbestul și
spuma de mare, precum și aluminosilicați, ca de exemplu
spinelul, MgO·Al
2O
3. În sol se găsesc întotdeauna combinații de calciu și de magneziu provenind din dezagregarea mineralelor.
Multe săruri de magneziu sunt dizolvate în apa mărilor sau a lacurilor sărate, cărora le imprimă gustul amărui. De asemenea, multe izvoare minerale conțin sulfat de magneziu dizolvat.
Plantele iau din pământ sărurile de magneziu, formând clorofila (în constituția clorofilei magneziul are același rol ca fierul în constituția hemoglobinei). Magneziul se mai găsește drept component al semințelor vegetale și chiar în corpul animal.
Obținere. Magneziul poate fi obținut prin diferite metode. Astfel, prin tratarea dolomitului calcinat cu apă de mare se îndepărtează calciul, prin schimb de ioni, echilibrul fiind favorabil din cauza solubilității mai mari a hidroxidului de calciu în comparație cu hidroxidul de magneziu:
Ca(OH)2·Mg(OH)2 + Mg2+ = 2Mg(OH)2 + Ca2+
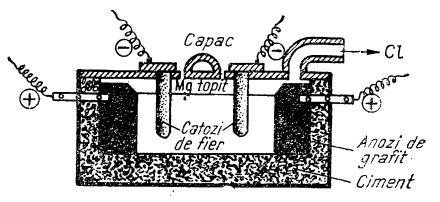
O metodă tehnică importantă pentru prepararea magneziului este electroliza carnalitului anhidru topit la 700-800°C. În loc de carnalit se poate folosi și clorură de magneziu anhidră în amestec cu CaCl2 și NaCl. La catodul celulei electrolitice (care este de fier) se separă magneziul care, fiind ușor, se ridică la suprafața topiturii de unde poate fi scos cu linguri speciale. La anod (care este de grafit) se separă clorul, care este aspirat (figura de mai jos). Magneziul obținut are puritatea 98-99% Mg; purificarea lui se face prin retopire în cuptoare electrice.
Celulă electrolitică pentru fabricarea magneziului
Însemnătate tehnică au și procedeele termice pentru obținerea magneziului, din care mai importante sunt procedeele carbotermice și silicotermice. După primul procedeu, oxidul de magneziu este redus cu cărbune la temperatura arcului electric (peste 2000°C):
MgO + C = Mg + CO
În al doilea procedeu, oxidul de magneziu este redus cu siliciu. În acest scop, dolomitul, în amestec cu siliciu sau ferosiliciu, este încălzit într-un cuptor electric la 1200-1300°C, sub vid înaintat:
2MgO + 2CaO + Si = Ca2SiO4 + 2Mg
Proprietăți fizice. Magneziul este un metal moale, alb, strălucitor, care cristalizează în sistemul hexagonal. Este ușor și maleabil, astfel încât poate fi laminat în table subțiri și tras în fire. Cu unele metale formează aliaje cu diferite aplicații în tehnica modernă.
Proprietăți chimice. Magneziul este stabil în aer uscat; în aer umed se acoperă cu un strat de oxid de magneziu care împiedică ca reacția de oxidare să se desfășoare mai departe. Din această cauză, magneziul are aspect mat.
Aprins în aer, magneziul arde cu flacără luminoasă, deoarece oxidul de magneziu devine incandescent din cauza căldurii mari de reacție:
Mg + ½ O2 = MgO;  H = -145,8 kcal/mol
H = -145,8 kcal/mol
Lumina dezvoltată este bogată în radiații ultraviolete.
În clorul umed se aprinde de la sine cu o reacție luminoasă și formare de clorură de magneziu, MgCl2; cu sulful se combină la temperatură mai ridicată; cu azotul se combină la cald formând nitrura de magneziu, Mg3N2.
Magneziul are acțiune reducătoare asupra substanțelor care conțin oxigen; astfel el poate arde și în dioxid de carbon, punând carbonul în libertate:
2Mg + CO2 = 2MgO + C
Apa atacă magneziul numai foarte încet datorită formării stratului protector de hidroxid de magneziu. Însă asupra vaporilor de apă magneziul are o acțiune puternic reducătoare:
Mg + 2H2O = Mg(OH)2 + H2
Amalgamul de magneziu reacționează cu apa chiar la temperatura obișnuită.
Din cauza tendinței pronunțate de a se combina cu oxigenul, magneziul poate reduce numeroși oxizi, proprietate folosită pentru obținerea unor elemente: bor, siliciu, carbon etc.
Magneziul poate forma cu combinații organice halogenate (de exemplu cu iod sau clor) compuși organo-metalici. De exemplu, cu iodura de metil, CH3I, formează iodură de metil-magneziu, MgICH3:
Halogenurile de alchil-magneziu au rol important în chimia organică ca agenți de sinteză (în reacția Grignard).
Magneziul reacționează cu acizi diluați, cu dezvoltare de hidrogen.
Utilizare. Dintre toate metalele grupei 2, magneziul este cel mai mult folosit ca metal. Datorită luminii puternice pe care o emană în timpul arderii, el se întrebuințează la fabricarea rachetelor luminoase și în fotografie. În metalurgie este folosit fie pentru purificarea unor metale (deoarece reduce oxizii și sulfurile formând combinații insolubile în topitură), fie pentru fabricarea unor aliaje. De asemenea este utilizat și în chimia organică preparativă.
Aliaje de magneziu. Magneziul se aliază cu aluminiul, care îi mărește rezistența la rupere, sau cu manganul, care îi mărește rezistența la coroziune în aer umed. Aliaje simple de magneziu cu aluminiu sunt la
magnaliul și
hidronaliul (vezi
Aluminiul).
Aliajele de magneziu care conțin circa 90% Mg, iar restul cantități mici de alte metale ca: aluminiu, zinc, cupru, mangan etc., sunt cunoscute sub numele de aliaje electron. Ele sunt rezistente față de hidroxizii alcalini și față de acizi, însă nu față de apă (pe care o descompun). Având o mare duritate și rezistență, precum și o densitate redusă, sunt folosite la fabricarea avioanelor, automobilelor, mașinilor industriale precum și confecționarea diferitelor instrumente.
Magneziul formează multe combinații de importanță industrială. Ca materii prime pentru obținerea lor se folosesc de obicei carbonatul și sulfatul de magneziu.
Oxidul de magneziu, MgO, numit și
magneziu usta, este produsul de oxidare directă a magneziului. El se obține și prin calcinarea hidroxidului, azotatului sau a carbonatului de magneziu. Industrial, se obține prin calcinarea magnezitului sau a hidroxidului de magneziu în cuptor electric, la 450°C:
MgCO3 = MgO + CO2
În țările așezate lângă mări și oceane, oxidul și hidroxidul de magneziu se obțin din apa mării. Aceasta se tratează cu lapte de var; precipită întâi carbonatul de calciu:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3 + 2H2O
după a cărui îndepărtare prin filtrare se adaugă din nou lapte de var, care precipită ionii Mg2+ sub formă de hidroxid de magneziu:
MgCl2 + Ca(OH)2 = Mg(OH)2 + CaCl2
Deoarece separarea hidroxidului de magneziu este anevoioasă, el este trecut, prin tratare cu dioxid de carbon, în carbonat hidratat:
Mg(OH)2 + CO2 + 2H2O = MgCO3·3H2O
prin a cărui calcinare rezultă apoi oxidul de magneziu:
MgCO3·3H2O = MgO + CO2 + 3H2O
Oxidul de magneziu cristalizează în rețele ionice de tipul NaCl. Este o pulbere albă, foarte ușoară, care cu apa trece în hidroxid de magneziu, Mg(OH)2, o bază slabă:
MgO + H2O = Mg(OH)2
El se topește la temperaturi foarte înalte (peste 2600°C). Din această cauză este folosit la confecționarea cărămizilor de magnezită, utilizate mai ales pentru căptușirea cuptoarelor Martin. Mai este folosit ca adaos al glazurilor pentru sticle și ceramică, ca umplutură pentru hârtie, ca suport de catalizator, etc.
Hidroxidul de magneziu, Mg(OH)
2, se obține prin tratarea unor săruri solubile de magneziu cu un hidroxid alcalin:
MgSO4 + 2NaOH = Mg(OH)2 + Na2SO4
sau prin acțiunea apei asupra oxidului de magneziu.
Se dizolvă foarte puțin în apă; soluția apoasă are o reacție slab alcalină. La încălzire puternică trece în oxid de magneziu. Hidroxidul de magneziu se folosește la prepararea cimentului magnezian, la rafinarea zahărului, în medicină, etc.
Sărurile de magneziu sunt ionice; în apă se găsesc sub formă de ioni hidratați [Mg(H2O)6]2+. Dizolvarea în apă a sărurilor de magneziu anhidre este însoțită de o puternică dezvoltare de căldură. Energia de hidratare fiind mare, sărurile de magneziu cristalizează din soluție apoasă sub formă de hidrați stabili.
Dintre sărurile de magneziu, mai importante sunt: clorura, carbonatul, sulfatul și diferiți silicați de magneziu naturali și artificiali.
Clorura de magneziu, MgCl
2, se găsește în natură dizolvată în apa mărilor sub formă de
carnalit. Ea se obține ca produs secundar de la leșiile mamă de carnalit rămase de la prepararea clorurii de potasiu. Din soluții apoase cristalizează de obicei cu șase molecule de apă, MgCl
2·6H
2O, formă în care are un domeniu mai larg de stabilitate ( de la -3,4°C până la +116,7°C); cristalele au un gust amărui și sunt foarte higroscopice. Deshidratarea hidraților cristalini nu se face prin încălzire, deoarece la 150°C, clorura de magneziu suferă o hidroliză parțială trecând în cloruri bazice (oxicloruri) de compoziție variabilă, de exemplu:
2MgCl2 + H2O ⇄ Mg2OCl2 + 2HCl
Această reacție de hidroliză a clorurii de magneziu are importanță în cazanele cu abur. Clorura de magneziu din apele dure care se depune împreună cu celelalte săruri formând piatra de cazane, produce la hidroliză acid clorhidric, care poate cauza coroziunea pereților cazanului.)
Cu cloruri alcaline, clorura de magneziu poate forma săruri duble. Un exemplu de asemenea sare este carnalitul, MgCl2·KCl·6H2O.
Dacă la o soluție foarte concentrată de clorură de magneziu se adaugă oxid de magneziu, se formează o masă păstoasă care după câteva ore se întărește devenind o masă albă lucioasă, foarte tare, cunoscută sub numele de ciment magnezian (ciment Sorel); el se folosește frecvent la fabricarea pietrelor pentru litografie, a imitațiilor de mozaic etc. Dacă înainte de întărire se amestecă cu rumeguș de lemn sau de plută, se obține xilolitul, care se folosește pentru pardoseli sau mese de laborator.
Clorura de magneziu se mai folosește în industria textilă (pentru a menține umed firul de bumbac, precum și ca apret), la fabricarea hârtiei permanganat, ca ignifug pentru lemn, ca materie primă pentru alte combinații de magneziu etc.
Carbonatul de magneziu, MgCO
3, este foarte răspândit în natură ca
magnezit, MgCO
3, sau ca
dolomit, MgCO
3·CaCO
3, cristalizate în sistemul hexagonal. Preparat pe cale artificială este o pulbere de culoare albă, greu solubilă în apă rece; sub 16°C cristalizează ca pentahidrat, iar la temperaturi superioare, ca tri- și chiar monohidrat. Încălzit la 450°C se descompune în oxid de magneziu și dioxid de carbon:
MgCO3 = MgO + CO2
Prin fierbere cu apă trece cu timpul în carbonați bazici.
Carbonatul de magneziu are multiple utilizări. Se folosește la prepararea altor săruri de magneziu, a magneziului metalic, a unor coloranți, la fabricarea cărămizilor refractare pentru construirea furnalelor electrice, la confecționarea conurilor Seger (care sunt indicatori de temperaturi înalte în ceramică), drept mediu filtrant, ca material de umplutură (pentru linoleum, cauciuc, hârtie), în medicină etc.
Sulfatul de magneziu, MgSO
4, se găsește în natură sub formă de kieserit, MgSO
4·H
2O, care însoțește frecvent sărurile de potasiu, și sub formă de
sare amară, MgSO
4·7H
2O.
Din soluție apoasă cristalizează întotdeauna cu șapte molecule de apă în cristale rombice, incolore, foarte solubile în apă și cu gust amar. Din această cauză i se mai spune sare amară.
Prin încălzire pierde treptat apa de cristalizare trecând în hidrați inferiori, până când la 200°C devine anhidru. Cu sulfați alcalini formează sulfați dubli, dintre care mulți se găsesc în natură.
Sulfatul de magneziu se întrebuințează în medicină (ca purgativ), în cosmetică, în industria tăbăcăriei, în industria textilă (ca mordant), la fabricarea hârtiei (ca material de umplutură), în industria ceramică etc. Sarea dublă K2SO4·MgSO4·6H2O este folosită drept îngrășământ.
Talcul este un silicat de magneziu hidratat, Mg2[Si4O10]·Mg(OH)2, respectiv 3MgO·4SiO2·H2O, care intră în compoziția multor roci. În rețeaua cristalină a talcului, straturile sunt mai slab legate între ele, astfel încât pot aluneca ușor unele pe altele. De aceea, talcul este moale (lasă urme pe stofă) și unsuros la pipăit.
Talcul se întrebuințează ca lubrifiant pentru unele mecanisme, la fabricarea creioanelor colorate (pastel), drept pudră cosmetică, ca umplutură pentru cauciuc și hârtie etc.
Steatitul are aceeași compoziție ca și talcul, Mg2[Si4O10]·Mg(OH)2. Prin topire la temperatură înaltă devine alb și sticlos. Fin măcinat, în amestec cu argilă și feldspați și ars la 1400°C, capătă un aspect un aspect de porțelan și folosesc pentru duze de țesătorie, articole pentru industria chimică, izolatori electrici, etc.
Azbestul este un silicat de magneziu cu compoziția Mg3[Si4O11]·3Mg(OH)2·H2O, respectiv 6MgO·4SiO2·4H2O. Are o structură fibroasă, este ignifug și are o foarte mică conductibilitate termică. Se întrebuințează ca izolator termic, garnituri pentru aparate în industrie (sub formă de plăci, hârtie sau țesături); apoi ca diafragme (în celule electrolitice), mase filtrante, suporturi pentru catalizatori etc.
Spuma de mare, numită și piatra ponce, este un silicat de magneziu hidratat, Mg3[Si6O15]·Mg(OH)2·3H2O, respectiv 2MgO·3SiO2·2H2O. Are culoare alb-gălbuie, duritate mică și se poate prelucra ușor. Fiind poroasă, plutește pe apă, de unde îi vine și numele. Se folosește în tehnică drept suport de catalizatori având mare putere de adsorbție. Se poate prepara și sintetic.
 H = -145,8 kcal/mol
H = -145,8 kcal/mol