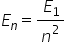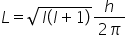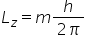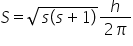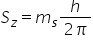Modelul păturilor pentru atomi cu Z>1. Numerele cuantice (n,l,m,mS).
Tag-uri
Partajeaza in Google Classroom

Transcript
în cea de a noua lecții de fizică
atomică vom discuta despre atomul
cu mai mulți electroni adică cu
10 mai mare decât 1 în lecțiile
trecute am discutat despre modelul
bohr și despre faptul că acesta
Explică foarte bine proprietățile
atomului de hidrogen precum energia
de ionizare sau seriile spectrale
să vedem acum cum stă situația
în cazul atomilor cu mai mulți
electroni în particular vom discuta
despre așa numit un model al pădurilor
electronice care a fost dezvoltat
de către veri savanți dar în principal
de către șoricel și pleacă de la
limitările modelul bohr după cum
am discutat deja când am dezvoltat
modelul bohr limit principala limitare
vine din tratarea simplistă a interacțiunilor
din atom mai exact se folosește
doar o forță electrostatica nucleo
electron dacă va aminti aveam așa
numita lege de sau condiție de
echilibru al orbitei electronilor
care spunea că forța centrifugă
este egală cu forța electrostatica
de interacție dintre nucleu și
electron și această forță electrostatica
era scrisă ca minus a pătrat împărțit
la 4 pini epsilon 0 aer unde R
era distanța dintre nucleu și orbita
electronului și ca o are care extensie
puteam folosi aceasta acest model
al lui bohr și pentru așa numiții
atunci hidrogenoizi adică atomi
cu 10 mai mare decât 1 dar cu un
singur electron acest model a lui
Bor funcționat foarte bine pentru
că aveam un singura interacție
în atom și anume cea dintre electroni
și nucleu în cazul atomilor cu
un sat mai mare decât unul nu mai
e suficient să avem numai această
forță de interacție ci bineînțeles
trebuie să adăugăm adăugăm și multitudinea
de interacției electrostatice dintre
electronii atomului mai exact trebuie
să avem un sumă de felul a pătrat
împărțit la 4 pi epsilon 0 în scuzați
Forța este cu er la pătrat Deci
Neptun 0 r e j la pătrat unde R
E J este distanța dintre electronul
e și electronul j mă acesta este
motivul și pentru care această
forță este pozitivă pentru că doi
electroni au sarcină în amândouă
lecturi nu au sarcina negativă
Deci produsul va fi pozitiv în
concluzie oprima extensii ar trebui
ar trebui să fie următoarea să
includem o multitudine de forțe
electrostatice de interacțiune
oricare pereche distinctă de electroni
Deci trebuie inclus interactive
Electro Electro mai mult decât
atât o simplificare o altă simplificare
mai puțin importantă dar care are
și impactul ei este faptul că Considerăm
aceste interacției de tip electrostatic
Dar bineînțeles ar trebui să Considerăm
cazul mai general din interactii
electromagnetice adică în care
toate componentele câmpurilor și
magnetice atâta ale nucleului cât
și ale electronilor aflați în mișcare
trebuie luate în considerare Spre
exemplu un atât nucleul cât și
electronii au un câmp magnetic
propriu generează un câmp magnetic
propriu deoarece sunt în mișcare
minți în principală electronilor
avea această proprietate și Deci
vom avea o valoare lui b pentru
a Câmpului magnetic propriu electronilor
de obicei notat Cum eu nu contează
acest lucru Ce contează este că
în scrierea ecuației interacției
dintre electroni Spre exemplu sau
dintre electroni și nucleu vom
avea o componentă pur magnetic
ar trebui să ținem cont de ea și
așa mai departe Deci în concluzie
ar trebui rescrisă în cazul atomilor
cu 10 mai mare decât 1 ar trebui
rest scrisă întreaga componentă
de interacție din atomi și dezvoltat
un nou model care să țină cont
de toate aceste componente această
problemă rezolvată de școală din
gara modelul său și inecuațiile
și ording este o problemă destul
de complicat în orice caz veste
nivelul de cunoștințe din liceu
ia se face la facultate dacă Alegeți
să faceți un fizica sau chimia
deci noi nu vom adresa rezolvarea
cantitativă adică numerică sau
analitică a atomului cu 10 mai
mare decât 1 și nu mai vom sublinia
principalele consecințe consecințe
cere ies din modelarea completă
a unui astfel de atom nici principala
consecință este că după ce include
De ce este interacția și rezolvă
ecuațiile nivelele energetice pe
care le aveam în cazul modelului
Bor Care erau descrise de numărul
cuantic principal bineînțeles de
vite mai complicate se transformă
în așa numitele pături electronice
care sunt descrise de un sat mai
complex de numere cuantice Deci
dacă în modelul bohr vorbeam de
nivele energetice descrise de numărul
cuantic principal și atât timp
cât știam valoarea lui n putem
calcula toate valorile tuturor
parametrilor electronului în principal
Spre exemplu energia electronic
pe un nivel energetic cu numărul
cuantic principal n dar puteam
calculat după cum am văzut și raza
orbitei și viteza pe orbită și
așa mai departe frecvența de rotație
și așa mai departe toate.ro legate
de acest an celelalte mărimi în
parametrii în ecuațiile acestor
parametri erau constant de ciudată
dat an pentru starea în care se
afla sau nivelul pe care se afla
un electrocutat calculator parametrii
același lucru se extinde și în
acest caz numai că în loc de un
număr cuantic avem patru pe care
îi vom explica imediat deci pe
lângă numărul cuantic principal
mai există trei alte numere cuantice
l m și m s care descriu starea
în care se află în electron Deci
în tabelul următor sumar ism acest
m numere cuantice Deci ce vedeți
aici este numele numărului cuantic
apoi mărimea caracteristică sau
mărimea Care este cel mai direct
legată de acel număr cuantic ecuația
în care apare explicit acelui număr
cuantic și valorile pe care le
poate lua acel număr cuantic fiind
un număr cuantic el Ia valori discrete
Deci primul număr cuantic este
numărul cuantic principal de care
am discutat deja în cadrul modelului
Bor care își păstrează aceeași
semnificație Deci numărul cuantic
principal este legat de energia
pături electronici în cazul acesta
El e legat de energie prin această
ecuație bine cunoscută de Ce este
energia stării fundamentale împărțită
la n pătrat și după cum știm n
ia cavalor orice număr întreg pozitiv
n este egal cu 1 2 3 4 și așa mai
departe acum noile numere cuantice
primul număr cuantic nou este așa
numitorul număr cuantic orbital
notat cu l mic El este legată de
momentul cinetic orbital prin relația
următoare valoarea absolută a momentului
cinetic orbital El este radical
din numărul cu anticor Beetle al
înmulțit cu el plus 1 înmulțit
cu HB HT HT la doi pini valorile
discrete ale acestui moment cinetico
orbita sunt toate valorile întregi
de la 0 până la el minus unu deci
el Ia n valori de la 0 la el minusul
Deci pentru un an dat el va avea
n valori motorul este momentul
magnetic orbital care este legat
de proiecția lui el pe o anumită
exces admis taxa de cuantificat
Deci l z m este legat de el zac
Deci valoarea lui el de a lungul
axei o zi prin această ecuație
iar numărul magnetic orbital m
este și el un număr întreg care
ia toate valorile de la minus la
plus Deci pentru un l dat Spre
exemplu pentru l egal cu doi avem
toate valorile de la minus 2 la
plus 2 Care sunt cinci valori 2
L plus 1 există un număr cuantic
de spin esti Dar nu la nota cu
roșu aici pentru că se întâmplă
ca acest număr cuantic de spin
să iau o singură valoare și atunci
el are practic o semnificație redusă
în noi nu putem obține în consecință
mai multe stări datorită acestui
număr cont ID Simt pentru că din
nou ilario singura valoare următorul
și ultimul număr important este
numărul Magnetic de spin MS Care
este proiecția pe axa a z a momentului
cinetic de spin și care ia două
valori de ce ia valoarea minusul
1 pe 2 și plus 1 pe 2 din acest
motiv și anume faptul că Ilia mai
mult de o valoare devină un număr
cuantic importantă pentru că duce
la multiplicarea cu 2-a număr a
numărului de stări posibile deci
sunt mari zând introducând interacțiunea
interacțiunea completă din atom
cu 10 mai mare decât 1 adică ținând
cont de toate aceste interacție
situația bineînțeles devine mai
complexă mai complicată în sensul
că energiile energetice scuzați
nivele energetice descrise de un
singur număr cuantic din modelul
Borg devin pături electronice descrise
de un set de patru numere cuantice
n l m și MN și vom vedea ce implică
aceasta un singur comentariu care
vom vedea imediat că este important
am spus că Gia unei pături electronice
sau mingea unei stări electronice
dacă doriți Este legată numai de
numărul cu anticipat prin această
formulă de fapt această afirmație
în principiu corectă dar în practică
există deviație în sensul că între
adevăr energia unei stări electronice
este dată de această formulă dar
există o mică corecție care depinde
de el deci există o mică componentă
a energiei unei stări a electronului
ce depinde și de el și aceasta
va avea implicații în