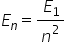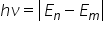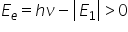Nivelele atomului de hidrogen. Tranziţiile atomului de hidrogen.
Tag-uri
Partajeaza in Google Classroom

Transcript
în cele 7 lecție de fizică atomică
vom discuta despre nivelele energetice
atomice în particular cele ale
atomului de hidrogen și despre
tranzițiile atomilor între aceste
nivele energetice în lecțiile trecute
am discutat despre modelul cu antical
atomului propus de bour și bineînțeles
îl vom folosi na în această lecție
pentru a discuta despre aceste
nivele energetice pentru a vizualiza
în modul cel mai simplu aceste
fenomene de tranziție între nivelele
energetice ale atomilor se folosește
o așa numită schemă a nivelelor
energetice ale unui sistem în general
sistem cuantic dar în particular
al atomului de hidrogen în cazul
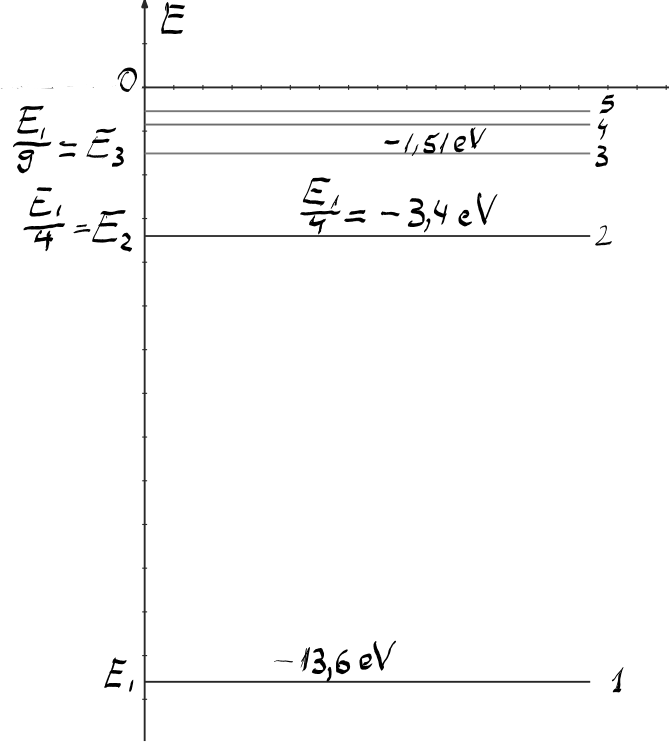
nostru această schemă fiind o diagramă
cu Axa verticală a energiei ce
cuprinde două zone această diagramă
are două zone o Vom desena imediat
cele două zone sunt următoarele
1 avem o zonă a energiilor cuantificate
care corespunde energiilor negative
și o zonă a energiilor continui
care corespunde zonei energiilor
pozitive Deci după cum am spus
o astfel de schema a nivelelor
energetice are o singură axa Care
este axa verticală pe care avem
energia În cazul nostru energia
va avea unități de electroni volt
pentru că aceasta este energetică
despre care vorbim în cazul unui
atom și bineînțeles vom avea pe
această axă nivelul 0 corespunzând
unei legi 0 după cum am văzut în
lecția trecută energiile electronilor
în tunat om sunt date de această
formulă și anume legea de cuantificare
a energiei în modelul bohr energia
nivelului n este egal cu energia
nivelului primului nivel orbitei
cele mai apropiate de nucleu care
se numește și starea fundamentală
energetică a Domnului împărțită
la m pătrat această energie este
negativă pentru că formula pentru
A1 energia stării fundamentale
este următoarea minus m i la patra
împărțit la 8 epsilon 0 pătrat
H pătrat Toate aceste mărimi sunt
constante și este în cazul acesta
faptul că avem un semn minus în
față de ceea ce este energie este
negativ în particular înlocuind
toate valorile constantelor obținem
o valoare pentru energia stării
fundamentale de minus 13 electronvolt
ca și comentariu în magnitudine
energia nivelului n este mai mică
împărțim la un un număr n pătrat
care crește cu el bineînțeles Deci
obține valori mai mici dar datorită
faptului că avem un minus în față
ele devin pe scara absolut a energiei
din ce în ce mai mari în particular
asta înseamnă că dacă Reprezentăm
starea fundamentală energia stării
fundamentale în această diagramă
ea a va corespunde unei energii
egal cu minus 13 electron volt Deci
acesta este e 1 care este starea
fundamentală și apoi putem reprezenta
celelalte stări așa numitele stări
excitate prima stare excitată e
doi Deci care corespunde numărului
cuantic principal n egal cu doi
va avea bineînțeles valoarea minus
13 împărțit la 4 adică 2 la pătrat
aceasta este nivelul energetic
i2 al primei stirex citate mici
prima stare excitat și așa mai
departe următorul nivel va corespunde
E3 va corespunde energiei minus
13 împărțit la 3 la pătrat adică
9 și acesta va fi E3 nivelul celei
de a treia plăcile de a doua scuzați
a doua stări excitate deci a doua
Star excitat și așa mai departe
scuzați putem observa că pentru
n egal cu infinit Deci pentru cele
mai înalte stirex citate posibile
energia de vin egală cu 0 Deci
acest spectru sau această diagramă
de nivele energetice se termină
la ING egal cu 0 pentru că e infinit
Adică n egal cu infinit va fi egal
prin definiție cu ii 1 împărțit
la infinit la pătrat adică zero
de spectrul nivelurilor cuantificate
ale atomului de hidrogen se termină
la energia 0 și de aceea vorbim
despre zona energiilor cuantificate
ale atomului în zona energiilor
negative bineînțeles putem ajunge
și în zona energiilor pozitive
pentru că dacă furnizăm suficientă
energie electronului ce se află
pe starea fundamentală eu nu el
poate se poate desprinde din atomul
de hidrogen și atunci va avea o
energie pozitivă care va fi formată
din suma dintre energia lui cinetică
și energia potențială de interacție
lectra statică cu nucleul care
rămâne în urmă această energie
este pozitivă și se află în această
zonă o desenez hașurat în felul
acesta Pentru că ea nu mai are
un spectru discret de valoare Deci
în zona pozitivă a energiilor continui
electronul poate avea orice energie
Deci nu mai avem o cuantificare
a energiei aceasta este schema
niveluri energetice ce reiese din
modelul bohr acum Haideți să vorbim
despre tranzițiile între aceste
nivele de energie postulatul 2
a lui bohr spune că tranziția atomului
dintre o stare en descrisă de numărul
cuantic principal m întru altă
stare e deschisă de un alt număr
cuantic principal m se face ori
cu emisie unei radiații electromagnetice
în cazul în care energia stări
inițial este mai mare decât cea
finală Deci dacă energie inițiale
mai mare decât cea finală atunci
tranziția se face cu eliberare
de energie sub forma acestei radiații
electromagnetice și invers dacă
energie inițiale mai mică decât
energia finală avem de a face cu
absorbția unei radiații electromagnetice
sau nepotul dacă vreți energia
bineînțeles a fotonului e misto
absorbit va fi egală cu modulul
diferenței dintre cele două nivele
energetice Deci mai concret pentru
a vizualiza folosind din nou schema
de nivele energetice Deci avem
energia exprimat în electronvolt
pe scara verticală avem nivelul
0 și Deci nivelele după cum am
discutat nivele energetice vor
fi în zona negativă E1 E2 E3 E46
mai departe în principiu un număr
infinit de nivele energetice electronul
se află în De obicei în starea
inițială fundamentală pe stare
fundamentală E1 și să zicem că
atomul nostru primește o anumită
cantitate de energie egală cu diferența
dintre nivelele 2 și eu atunci
bineînțeles ce se va întâmpla este
că atomul va folosi această energie
electromagnetice extra magnetice
de energie H1 pentru a muta electronul
de pe primul nivel nivelul starea
fundamentală pe prima stare excitată
e 2:00 și Deci energia fotonului
care provoacă această tranziție
va fi egală cu a 2 minute 1 dacă
energia fotonului este mult mai
mare Spre exemplu egală cu a 4
minus se1 Deci dacă aș nu este
egal cu a 4 minus se1 Deci mai
mare atunci bineînțeles că tranziția
se va face de pe starea fundamentală
unul pe cele a treia stare excitată
de energie patru odată ajuns pe
această stare excitată A4 pe exemplu
Bineînțeles că atomul va încerca
să revină pe starea fundamentală
care are energia minimă el poate
face acest lucru direct Deci poate
emite același fotin Haș nud cu
e4100 1 și tranzitat direct de
pe nivelul A4 pe starea fundamentală
e unul sau poate face în trepte
Adică poate merge de pe tranzitat
de pe 4 pe 3 de pe a3 pe A2 și
în fine de pe A2 pe 1 Deci orice
combinație de nivele de tranziții
de sus în jos Este posibilă cu
emisie a unui număr corespunzător
de fotoni în cazul acesta un singur
fotin cu o energie mai mare în
cel de al doilea caz trei fotoni
cu energie mai mici corespunzător
disa corespunzătoare diferențelor
dintre aceste nivele de ce avem
mai multe tipuri de des excitări
în funcție de Calea pe care o alegere
electronul pentru revenit pe starea
fundamental în fine avem un alt
fenomen Posibil și anume cel de
ionizare a atomului dacă atomul
aflat de obicei bineînțeles în
stare fundamentală E1 primește
o energie de la radiații electromagnetică
energie h&m mai mare decât 1 atunci
Bineînțeles că electronul fapte
starea fundamentală va efectua
o tranziție direct în spectrul
continuu Deci dacă hazliu e mai
mare decât eu nu Asta înseamnă
pur și simplu că electronul aflat
în această pe acest nivel va tranzita
în spectrul continuu asta înseamnă
că el devine liber devine un electron
liber ceea ce este semnificația
termenului de ionizare separăm
pur și simplu electronul de nucleul
său și obținem așa tonul de atomul
de vine un Ion energia electronului
va fi bineînțeles diferența dintre
energia primită și energia E1 pe
care se afla el inițial și după
cum am spus aceasta devine o energie
pozitivă aflată în spectrul contin
ia poate lua orice valori pozitive
la limita în care energia electronului
eliberat de vine aproape egală
cu 0 atunci energia fotonului care
produce un electron liber de energie
foarte mică de vino aproximație
foarte bună pentru valoarea energiei
nivelului fundamental al atomului
de hidrogen care după cum știm
ar trebui să fie 13 electronvolt
aceasta constituit prima verificare
experimentală a modelului bohr
și anume pur și simplu sa variat
energia fotonului care interacționează
cu atomul până când sau obținut
o eliberare electronică ionizare
a atomului și să măsurat dependența
energiei electronului pe care am
notată cu e E ca funcție de energia
fotonului și bineînțeles avem o
astfel de dependență liniară Nu
dar Important este că la o energie
electronului egală cu 0 energia
fotonului măsoară energia primului
nivel energetic al atomului de
hidrogen al stării fundamentale
Deci în felul acesta reprezentând
energia electronului eliberat ca
funcție de energia fotonului Ce
provoacă această eliberare și extrapolând
această linie până intersectează
axa orizontală putem Măsura 1 și
intră adevărul acesta sau obținut
o valoare foarte aproape de cea
calculată Teoretic și anume 13 electro