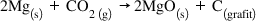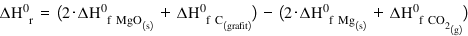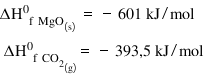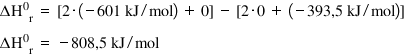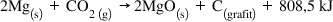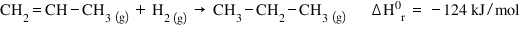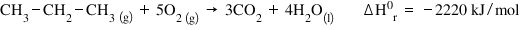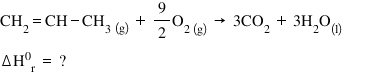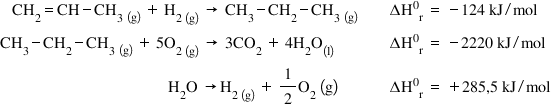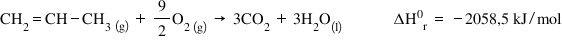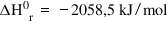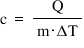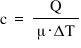Noţiuni de termochimie – aplicaţii
Tag-uri
Partajeaza in Google Classroom

Transcript
această lecție vom vedea cât de
bine au reușit să asimilăm noțiunile
teoretice din lecțiile trecute
vom aplica în câteva probleme de
calcul pentru început această reacție
dintre magneziu și dioxid de carbon
Hai să vedem care este entalpia
standard de reacție și să vedem
Și dacă reacția degajă sau șarpe
căldură și dacă este o reactie
exoterma sau reacții endoterme
mai întâi aplicăm relația de calcul
la in talpi standard de reacție
bine tălpile standard de formare
ale produșilor și ale reactanți
Așadar avem entalpia Standard reacție
Care este egală cu suma Intel pilor
standard de formare ale produșilor
minus suma in talpilor standard
de formare ale reactanților nu
uităm că ținem cont și de numărul
de moli despre evaluările în talpilor
sun dar de formare timp de lecțiile
trecute că majoritatea sunt calculate
Dej de oamenii de știință iar noile
aveți la dispoziție un tabele sau
anexa turnați fel de table am găsit
valoarea entalpiei standard de
formare pentru oxidul de magneziu
și evaluarea entalpie standard
de formare pentru dioxidul de carbon
Cât despre entalpiile de formare
ale magneziului și carbonului să
ne reamintim că prin convenție
să stabili că substanțele elementare
au intentiile standard de formare
egal cu 0 si astfel având aceste
valori înlocuim în relația noastră
și obținem ca in talpi ia de reacții
în condiții Standard este egală
cu minus 800 8 kg pe mall semnul
minus Ia spune că sistemul pierde
nervi așa dar această cantitate
de căldură se degajă atunci când
are loc reacția ești reacția dintre
magneziu și dioxidul de carbon
este o reactie exoterma legea lui
hess spune că putem aduna căldurile
de reacție Haideți să vedem în
continuare La ce ne ajută acest
lucru la rele două reacții alături
de talpile lor Thunder de reacții
prima este reacția de hidrogenare
a propenei iar a doua este reacția
de combustia propanului și ce regele
Problema este să calculăm entalpia
stendarr a reacției de combustia
a propenei practic datorită legii
lui hess simt că putem asamblări
axei termodinamică pentru care
lipsesc datele sau pentru care
e mai greu să aflăm datele deci
putem asamblarea ție din alte reacții
pentru care a venit formațiile
termochimice mai la îndemână acestei
reacții pe care ni le dă datele
problemei puteți le adunăm sau
să le scădem alături de alte reacții
care ar fi de folos până când obținem
reacția de care avem nevoie și
apoi vom aduna sau vom scade și
în tălpile de reacție la același
mod Haideți analizăm reacțiile
pe care le avem pentru că în reacție
de combustie pe care trebuie să
obținem Nu apare nici o moleculă
de hidrogen Deci va trebui să scăpăm
de hidrogenul din prima reacție
avem cinci moli de oxigen în a
doua reacție nouă ne trebuie numai
4 sau nouă pe doi moli un mol de
propenă îl avem aici 3 moli de
dioxid de carbon de aici și mai
vedem că avem nevoie de trei moli
de apă iar nu e aici avem patru
moli de apă trebuie să scăpăm de
unii Deci avem nevoie de un mol
de apă trap reactant astfel se
va reduce cu un Mol de apă de pe
partea produșilor de reacție și
ne vom folosi de reacția de descompunere
a unui Mol de apă lichidă în tabele
găsim entalpia standard de formare
a unui Mol de apă lichidă această
valoare este pentru această reacție
vedem că este pentru reacția inversă
să le de care avem noi nevoie astfel
valoarea intai Standard a reacției
pentru descompunerea apei va fi
valoarea opusă entalpiei de formare
a apei adică va fi plus 200 85 kg
pe mall și acum ne mai rămâne să
adunăm aceste reacții și să vedem
dacă obtinem și numerele de moli
de care avem nevoie nu le curea
de propan din reacția a doua si
reduce cu cea din prima reacție
Mol de substanță care se află pe
partea reactanților poate fi născut
moli de substanță care se află
pe partea produșilor de apă se
reduce cu unul de aici Deci rămânem
cu trei apoi avem unul pe doi moli
de oxigen care se reduc din acești
5 moli de oxigen Deci rămânem aici
cu un nouă pe doi moli ceas fan
reacția pe care o ține este reacția
de combustie de care avem nevoie
singură operație matematică pe
care a fost să adunăm acestor ea
și pentru a afla și valoarea entalpiei
standard areactiv de combustie
a propenei nu trebuie decât să
aplicăm acele și relații și valorilor
în talpilor de reacție și în cazul
nostru Trebuie doar să le adunăm
și obținem astfel valoarea de care
avem nevoie minus 2000 58 km ore
în continuare vom calcula câtă
căldură se degajă la arderea a
patru normal metri cubi de metan
și avem reacția de arderea metanului
se cunosc în tălpile molare de
formare Standard ale compușilor
participanți la reacții astfel
putem calcula foarte simplu entalpia
stat dar de reacții de suma in
talpi lor de formare a produșilor
mii numai în tălpi lor de formare
a reactanților facem calculul numeri
și obține În valoare în tălpi standardele
de arderea unui Mol de Metan de
la arderea unui Mol de Metan se
degajă 800 2 kg acum Trebuie să
aflăm Câți moli de Metan se află
în patru normal metri cubi pentru
gaze numărul de moli este egal
cu volumul de gaz supra 22 l pe
metru cub avem 1.000 de L Deci
numărul de moli va fi egal cu 4
ori Românie supra 20 2 și astfel
vedem că în 4 m cubi de Metan avem
178 regulă 57 moli de gaz mai înainte
am văzut că un mol de Metan degajă
la arderea a 800 2 kg cifre regula
de trei simple calculăm valoarea
care ne interesează Așadar la arderea
a 4 normal metri cubi de Metan
se degajă 143 virgulă 231 Mega
Juli Haideți să vedem acum câtă
apă putem încălzit de la 0 grade
la 100 de grade Celsius prin arderea
unui Mol de Metan o să pentru asta
avem nevoie de o noțiune numită
căldură specifică căldura specifică
reprezintă cantitatea de căldură
necesară pentru a încălzi unitatea
de masă dintre o substanță astfel
încât temperatura e să primească
cu un grad notăm căldura specifică
cu litera C mic aceasta este expresia
matematică a căldurii specifice
căldură supra masa ori variația
de temperatură astfel măsurăm căldura
specifică în chiloți pe kilogram
ori cal de obicei căldurile specifice
ale anumitor substanțe sunt oferite
în datele problemei dacă nu ele
se găsesc în tabele și anexele
pentru majoritatea substanțelor
ele fiind deja măsurate și calculată
de oamenii de știință o altă noțiune
este căldura specifică molară căldura
specifică molară reprezintă cantitatea
de căldură necesară pentru încălzirea
unui Mol de substanță A astfel
încât temperatura substanței să
crească cu un grad și aceasta este
expresia matematică căldură supra
număr de moli ori variația temperaturii
Deci căldura specifică molară se
măsoară în chiloți jul pe Mahler
Calvin problemă mi se cere masa
de apă în grame încălzită de faza
de Celsius la 100 de grade Celsius
prin arderea unui Mol de Metan
Haideți să vedem Care sunt datele
pe care le cunoaște În primul rând
am văzut că la arderea unui Mol
de Metan se degajă o căldură de
800 2 kg Deci q căldura pe care
la dispoziție pentru încălzirea
apei este egală cu 800 2 kg Delta
t este egal cu temperatura finală
la care vrea să se ajungă minus
temperatura inițială Deci Delta
t este egal cu 100 grade Celsius
minus 0 grade Celsius sau cu 370
și 3 Kelvin -273 cal și variația
va fi de 100 de grade căldura specifică
Ești o valoare destul de cunoscută
care de obicei Fieni se dă în problema
fie o găsim în tabele și este egală
cu 4 86 Juli pe gram aur Calvin
Deci avem relația călduri specifice
de unde ai singura necunoscută
este m adică masă M este egal cu
q supra c ori dentate și acum putem
înlocui cu valorile numerice am
înmulțit aici cu 1000 pentru că
am făcut conversia din kilojouli
efectuând calculul și vedem că
Masa este egală cu 1916 virgulă
14 grame de apă Așadar prin arderea
unui singur Mol de Metan putem
încălzi aproape 2 kg de apă de
la 0 grade la 100 de grade c