Oxidul de fier(III) sau oxidul feric, Fe2O3, este un solid insolubil de culoare roșu-brun spre negru; are punctul de topire 1565°C. Există și forma hidratată a oxidului de fier(III), Fe2O3·nH2O, care este o pulbere roșu-brună.
Oxidul de fier(III) se găsește în natură ca mineralul
hematit care are structura cordinonului (
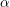
-Al
2O
3), anume hexagonal-compactă, și se numește
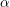
-Fe
2O
3. Hematitul constituie o materie primă importantă pentru extragerea fierului. Oxidul de fier(III) se poate prepara și prin calcinarea oxidului de Fe(III) hidratat, când are structură cubică compactă și se numește
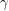
-Fe
2O
3. Se prezintă ca o pulbere roșie sau ca o masă cristalină de culoare închisă, foarte rezistentă față de acizi. În stare topită este folosit la prepararea electrozilor, diafragmelor și vaselor care trebuie să aibă o mare rezistență (în procese chimice și electrolitice). Uneori se adaugă în compoziția unor vopsele (când este cunoscut sub numele de “miniu de fier”, “ocru roșu” sau “roșu de Veneția” etc.). De asemenea folosește drept catalizator la prepararea anhidridei sulfurice, în ceramică pentru smalțuri, în industria textilă ca mordant, în industria cauciucului etc.
Oxidul de fier(III) hidratat
Oxidul de fier(III) hidratat se găsește răspândit în natură ca diferite minerale în a căror compoziție conținutul de apă variază. Numai limonitul, care este aparent amorf, și modificația lui cristalină, goethitul, au un conținut definit de apă, corespunzător formulei Fe2O3·nH2O. Proaspăt precipitat are mare putere de adsorbție. Oxidul de Fe(III) hidratat reacționează ușor cu acizii diluați, formând săruri; poate reacționa și cu hidroxizi alcalini concentrați la cald, formând ferați(III) ca, de exemplu, feratul (III) de sodiu, NaFeO2. Prin urmare, oxidul de Fe(III) are caracter amfoter, dar mai slab acid decât hidroxidul de aluminiu.
Sub formă coloidală se întrebuințează la purificarea apelor, în industria hârtiei, ca liant al pietrelor artificiale și în medicină.






