Oxigenul, O, este un element chimic gazos, inodor și incolor din grupa 16 (VIA) cu număr atomic 8 și masă atomică 15,9994. Oxigenul este un element esențial în respirația celulară și în procesele de combustie; este cel mai răspândit element din scoarța pământului (incluzând atmosfera) și reprezintă peste 20% din aer (în volume).
Oxigenul este unul dintre cele mai răspândite elemente din natură. El formează jumătate din scoarța pământului (inclusiv atmosfera).
În stare liberă, oxigenul se găsește în aerul atmosferic, constituind a cincea parte din acesta (20,9% în volume, respectiv 23% în masă); în straturile superioare ale atmosferei (peste 60 km înălțime) acest procent este mai scăzut.
Cea mai mare cantitate de oxigen din natură se găsește însă sub formă de combinații: astfel, numai în apă, el se găsește în proporție de 88,81% (în masă). De asemenea, majoritatea mineralelor conțin oxigen în compoziția lor.
În natură există un continuu consum de oxigen, datorită proceselor de respirație animală, putrefacțiilor și, mai ales, industriilor care consumă cantități enorme de aer pentru combustie. Aceasta ar trebui să ducă la o permanentă scădere a procentului de oxigen din aer și la o creștere a conținutului de dioxid de carbon. Pierderea este însă compensată prin punerea în libertate a oxigenului din dioxid de carbon, în urma procesului de asimilație clorofiliană a plantelor, sub acțiunea luminii solare. Prin aceasta se menține un circuit al oxigenului în natură.
Oxigenul se obține din substanțe care îl conțin și îl cedează ușor.
În laborator, oxigenul se obține din clorat de potasiu, KClO
3, permanganat de potasiu, KMnO
4, dioxid de plumb, PbO
2, oxid roșu de mercur, HgO, etc. prin descompunere termică:
2KClO3 → 2KCl + 3O2
2KMnO4 → K2MnO4 + MnO2 + O2
2PbO2 → 2PbO + O2
2HgO → 2Hg + O2
Aceste descompuneri au loc la temperaturi destul de înalte; de aceea se adaugă catalizatori. De exemplu, descompunerea cloratului de potasiu, care în mod obișnuit are loc la temperatură de aproximativ 370°C, în prezența dioxidului de mangan se produce la aproape 280°C.
Pentru prepararea unor cantități mai mari de oxigen, în laborator se încălzește un amestec de clorat de potasiu și dioxid de mangan într-un balon de sticlă prevăzut cu un tub de culegere (ilustrat în figura de mai jos):
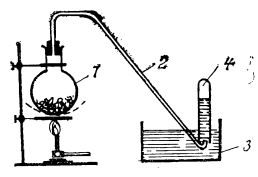 Dispozitiv pentru obținerea oxigenului în laborator:
1
Dispozitiv pentru obținerea oxigenului în laborator:
1 - balon cu amestec de clorat de potasiu și bioxid de mangan;
2 - tub de culegere;
3 - cristalizor cu apă;
4 - eprubetă pentru colectarea oxigenului.
a) Distilarea fracționată a aerului lichid (procedeul Linde): În mod curent, oxigenul se obține din aer, care, fiind un amestec de diferite gaze, poate fi separat în componente pe baza diferenței dintre punctele de fierbere ale gazelor componente. În acest scop, aerul este lichefiat la temperatură joasă, apoi supus unei distilări fracționate. Întâi distilă azotul, care are punctul de fierbere de -195,8°C și apoi oxigenul, al cărui punct de fierbere este -182,96°C.
Asemănător este procedeul lichefierii fracționate a aerului (procedeul Claude).
b) Electroliza apei: Oxigenul se poate prepara o dată cu hidrogenul prin electroliza apei.
Oxigenul obținut prin oricare dintre metodele tehnice este comprimat la 150 atm în tuburi de oțel, pentru a fi dat spre consum.
Oxigenul este un gaz fără miros și fără gust. În strat subțire este incolor; în strat mai gros apare albăstrui. Este de 1,1 ori mai greu decât aerul. Oxigenul se dizolvă în apă, deși în cantitate mică (la 20°C se dizolvă 3,11% în volume), făcând astfel posibilă viața animalelor din apă. Prin lichefiere, oxigenul trece într-un lichid de culoare albastră, care prin solidificare se transformă într-o masă cu aspect de zăpadă albăstruie.
În condiții obișnuite, molecula oxigenului este biatomică; ea este foarte stabilă.
Unele comportări ale oxigenului arată că formula O = O, atribuită moleculei lui, nu corespunde întru totul. De aceea, Linus Pauling admite că atomii de oxigen sunt uniți în moleculă prin trei legături, și anume o covalență simplă și două legături formate din câte trei electroni (legături trielectronice), ceea ce se reprezintă prin formula

(liniuța “—” reprezentând covalența).
Oxigenul este foarte reactiv. După
fluor este elementul cel mai electronegativ. Se combină cu cele mai multe elemente, formând oxizi, reacții însoțite întotdeauna de degajare de căldură și chiar de lumină; ele se desfășoară diferit după natura elementului respectiv și după condițiile de reacție.
Reacțiile oxigenului cu metalele
Sodiul, la rece, se oxidează imperceptibil; la temperatură ridicată, reacția se desfășoară însă energic și rezultă peroxidul de sodiu, Na
2O
2. Magneziul, după ce este aprins, arde cu lumină puternică albă și formează oxidul de magneziu, MgO. Aluminiul, ca și fierul, necesită o temperatură mult mai înaltă pentru a putea arde în oxigen; rezultă oxidul de aluminiu, Al
2O
3, respectiv oxidul de fier, Fe
3O
4. Metalele prețioase (aurul, platina) nu se combină direct cu oxigenul; oxizii lor se obțin pe cale indirectă.
Pentru demonstrarea reactivității oxigenului cu metale se umplu cu oxigen două vase de sticlă prevăzute cu câte o placă de închidere de care sunt fixate, la una o spirală de sârmă de magneziu, iar la cealaltă, o spirală de sârmă de fier. La capătul spiralelor sunt fixate bucățele de iască ce sunt aprinse și introduse în vasele cu oxigen; sârma de magneziu arde cu flacără orbitoare, pe când sârma de fier arde fără flacără, dar răspândind scântei.
Reacțiile oxigenului cu nemetalele
Și nemetalele reacționează diferit cu oxigenul. Astfel, fosforul alb se aprinde la ușoară încălzire și trece în pentoxid de fosfor, P
2O
5. Sulful trebuie în prealabil aprins pentru ca să se desfășoare arderea lui în oxigen; se formează dioxid de sulf, SO
2. Carbonul arde în oxigen numai după ce a fost puternic încălzit; se produce dioxid de carbon, CO
2.
Pentru demonstrație, în trei vase umplute cu oxigen se introduc, fixate la capătul unor sârme groase:
-
Un creuzet cu o bucățică mică de fosfor alb aprins (prin atingere cu o sârmă fierbinte);
-
Un creuzet cu o bucățică de sulf aprins;
-
O bucățică de cărbune încălzit până la roșu în flacăra unui bec.
Fosforul arde cu flacără vie, iar vasul respectiv se umple cu un fum alb de pentoxid de fosfor; sulful arde cu flacără albăstruie, iar basul respectiv se umple cu un fum alb cu miros înțepător de dioxid de sulf (identificat prin puterea lui reducătoare: decolorarea unei hârtii îmbibate cu o soluție diluată de permanganat de potasiu); cărbunele arde cu lumină puternică, iar vasul se umple cu dioxid de carbon (identificat după formarea precipitatului insolubil de carbonat de calciu, CaCO3, rezultat la introducerea în vas a unei soluții de hidroxid de calciu).
Unii oxizi inferiori se pot combina cu oxigenul trecând într-un grad superior de oxidare. Astfel, oxidul de azot, NO, se combină la rece cu oxigenul și trece în dioxid de azot, NO2; oxidul de carbon CO, arde în oxigen trecând în dioxid de carbon, CO2; dioxidul de sulf, SO2, se combină cu oxigenul la cald, în prezență de catalizator, și trece în trioxid de sulf, SO3 etc.
În oxizi, legătura element—oxigen are un caracter care variază între pur ionic și pur covalent, după natura elementului. Astfel, la oxizii metalelor alcaline, ca de exemplu Na2O, legătura element—oxigen este electrovalentă. Formarea ionului O2- din oxigen molecular necesită însă un consum mare de energie (227 kcal/mol). De aceea, el nu există decât în rețele cristaline care au energia de rețea foarte mare. Oxizii ionici sunt stabili numai în stare solidă; în prezența apei, ionul O2- trece imediat în ioni hidroxid:
O2- + H2O → 2OH-
Pe măsură ce sarcina ionului pozitiv crește și volumul său se micșorează, legătura element—oxigen capătă caracter covalent, ca de exemplu la BeO sau B2O3. La acești oxizi, energia de rețea este insuficientă ca să permită o ionizare completă. Oxizii elementelor cu valențe superioare, ca de exemplu CO2, oxizii de azot, de fosfor, sulf, sunt compuși moleculari pur covalenți. Ei pot fi gaze, lichide sau solide.
Din punct de vedere chimic, oxizii sunt clasificați după caracterul lor acid sau bazic în sistem apos (vezi
Oxizi).
Reacțiile oxigenului cu compușii organici
Din cauza afinității lui pentru hidrogen, oxigenul reacționează cu compușii care conțin hidrogen. Importante sunt îndeosebi reacțiile oxigenului cu combinațiile organice, care conțin hidrogen și carbon (din reacții rezultă apă și dioxid de carbon); ele stau la baza procesului de ardere a combustibililor.
Combustii. Oxidările însoțite de o degajare energică de căldură și lumină se numesc
arderi vii sau
combustii. Astfel, arderea în oxigen a cărbunelui, fosforului, sulfului, fierului, etc. sunt combustii. Deoarece oxigenul la temperatura obișnuită are o reactivitate mică, pentru ca să aibă loc combustiile este necesară o încălzire prealabilă a substanțelor până la atingerea unei anumite temperaturi, numită punctul de aprindere, după care căldura dezvoltată de reacția de oxidare întreține singură oxidarea. Uneori, din cauza energiei degajate în timpul reacției,
punctul de aprindere este depășit și oxidarea decurge tot mai energic. Astfel, când se aprinde o panglică de magneziu (la circa 750°C), arderea este însoțită de lumină orbitoare, iar temperatura poate ajunge până la 3000°C.
Punctul de aprindere diferă de la o substanță la alta. Deoarece depinde de o serie de factori - de exemplu la substanțe solide de forma și de starea lor de diviziune, la substanțe gazoase de presiunea la care se găsesc, etc. - el nu este o constantă a substanței respective. Astfel, fierul sub formă de pulbere se aprinde ușor în oxigen și arde răspândind scântei, pe când o bucată masivă de fier trebuie încălzită la o temperatură foarte înaltă ca să se poată oxida.
În aer, oxidarea este mult mai lentă decât în oxigen. De exemplu, metanul se aprinde în aer la o temperatură de 650 - 750°C, iar în oxigen la 556-700°C; alcoolul se aprinde în aer la 558°C, iar în oxigen la 425°C; fierul poate arde în oxigen, dar nu în aer.
Faptul că în oxigen pur toate reacțiile de ardere se desfășoară mai intens decât în aer se datorează existenței în aer a azotului, care nu întreține arderea și consumă din căldura degajată în timpul reacției de oxidare pentru propria lui încălzire până la punctul de aprindere a substanței supuse arderii. Un exemplu îl reprezintă însăși reacția de recunoaștere a oxigenului, și anume arderea cu flacără vie în atmosfera de oxigen a unui bețișor de lemn care abia arde, fără flacără, în aer.
De aceea, pentru intensificarea reacțiilor de oxidare care stau la baza unor procedee tehnice se mărește proporția de oxigen din aerul folosit la oxidare, sau, în anumite cazuri, se întrebuințează chiar oxigen pur.
Câteodată reacțiile de oxidare sunt atât de energice, încât se transformă în explozii. De exemplu, amestecul de aer și gaze combustibile (hidrogen, acetilenă, metan, etc) sau vapori de substanțe inflamabile (benzină, eter, sulfură de carbon, acetonă etc.) explodează.
Combinarea oxigenului cu hidrogenul pentru a forma apa se face după mecanismul reacțiilor înlănțuite. La temperaturi sub 450°C, reacția se produce dacă în sistem există atomi liberi de hidrogen, care să inițieze lanțuri de reacție. Când reacția, care este puternic exotermă, are loc într-un spațiu închis, creșterea bruscă a presiunii datorită dilatării gazelor în urma ridicării temperaturii produse de căldura de reacție, precum și creșterea numărului de molecule de gaz care rezultă din reacție, determină apariția exploziei.
Desfășurarea reacției se face prin atomi și radicali liberi. La reacția dintre hidrogen și oxigen, în primul stadiu, la temperaturi mai joase, în cursul reacției înlănțuite se poate forma și apă oxigenată, H2O2:
(1) H ・ + O2 → H — O — O ・
(2) H — O — O ・ + H2 → H — O — O— H + H ・ etc.
La temperaturi mai înalte, reacția (1) se poate desfășura astfel:
H ・ + O2 → ・ OH + O ・
O ・ + H2 → ・ OH + H ・ etc.
Iar reacția (2) se poate desfășura în modul următor:
H — O — O ・ + H2 → H2O + ・ OH
・ OH + H2 → H2O + H ・ etc.
În realitate, mecanismul reacției este însă cu mult mai complicat.
Oxidări lente. În prezența umidității, oxidările pot decurge într-un timp mai lung, fără dezvoltare de lumină și fără dezvoltare aparență de căldură. Un exemplu cunoscut de astfel de oxidare lentă este ruginirea fierului. Tot o oxidare lentă este și respirația animală. Cantitatea de căldură dezvoltată în timpul oxidărilor în corpul omenesc este extrem de mare. Dacă ea s-ar acumula timp de 24 h, temperatura corpului ar ajunge la 100°C. Oxidările fiind însă lente, organismul are timp să cedeze căldura mediului exterior și astfel temperatura corpului se menține la 36-37°C.
Uneori, când căldura eliberată în timpul unei oxidări nu este îndepărtată cu ajutorul curenților de aer, ea se poate acumula și în cele din urmă poate ridica temperatura substanței la temperatura de aprindere. Acest fenomen se numește autoaprindere. Așa se explică de ce se aprind de la sine căpițe de fân, grămezi mari de cârpe, bumbac și chiar de cărbune mărunt, când sunt depozitate mai mult timp.
Oxigenul are foarte multe întrebuințări în diferite domenii.
În industria chimică, oxigenul este utilizat la oxidarea amoniacului pentru prepararea acidului azotic; la fabricarea acidului sulfuric, dioxidul de sulf se amestecă cu aer îmbogățit cu oxigen, obținându-se astfel randamente mai bune. Ca utilizări ale oxigenului se mai menționează obținerea uleiurilor sicative, albirea hârtiei, etc.
Una dintre cele mai uzuale întrebuințări ale oxigenului în tehnică este la sudura autogenă. În acest scop se folosesc “suflătoare”, în care oxigenul și acetilena pătrund prin două canale separate, se amestecă la capătul suflătorului și ies arzând printr-o duză. În loc de acetilenă se poate folosi și hidrogen. Cu flacăra oxiacetilenică (oxigen și acetilenă) se pot obține temperaturi până la 3000°C, care permit tăierea și lipirea metalelor, topirea și prelucrarea sticlei, cuarțului, platinei și a altor substanțe greu fuzibile; cu flacără oxihidrică (oxigen și hidrogen) se obțin temperaturi până la 2500°C.
În metalurgie, îndeosebi în siderurgie, se consumă cantități din ce în ce mai însemnate de oxigen pentru îmbogățirea cu oxigen a aerului suflat în furnale (realizând astfel economie de combustibil și scurtarea timpului de reacție); de asemenea, uneori se suflă direct oxigen în convertizoare.
Prin îmbibarea cu oxigen lichid a unui cărbune poros, rumeguș de lemn sau parafină, se prepară un exploziv folosit la lucrări miniere.
Oxigenul are o mare importanță biologică. Inspirat, pătrunde prin plămâni în sânge, unde cu hemoglobina formează o combinație nestabilă, oxihemoglobina. În cursul circulației sanguine, oxihemoglobina ajunge la vasele capilare ale organismului, unde se descompune; oxigenul trece în țesuturi unde, prin oxidările lente care au loc, se produce căldura animală necesară organismului. Dioxidul de carbon rezultat din arderi este expirat prin plămâni. Un om matur consumă pe oră circa 20 L oxigen; la eforturi fizice, această cantitate este mult mai mare.
Deoarece echilibrul:
oxigen + hemoglobină  oxihemoglobină
oxihemoglobină este dependent de concentrația oxigenului, trebuie introdus oxigen ori de câte ori respirația nu se poate face în condiții normale. De aceea, când se lucrează în atmosfere impurificate cu gaze toxice sau la înălțimi mari, unde procentul de oxigen din aer este redus (cazul aviatorilor), precum și sub ape (cazul scafandrilor), se folosesc măști de protecție izolante prevăzute cu mici rezervoare de oxigen.
Oxizii obișnuiți și
peroxizii se deosebesc prin faptul că oxizii sunt considerați derivați ai apei, iar peroxizii sunt considerați derivați ai apei oxigenate (vezi
Oxizi). Atât în oxizi cât și în peroxizi oxigenul este
bivalent.
În peroxizi, numărul de oxidare al oxigenului este -1, pe când în oxizi este -2; deci, peroxizii reprezintă un grad de oxidare intermediar între oxigenul liber și oxizii obișnuiți.
Importante sunt combinațiile oxigenului cu hidrogenul:
apa (care este un oxid de hidrogen) și
apa oxigenată (care este un peroxid de hidrogen).

 (liniuța “—” reprezentând covalența).
(liniuța “—” reprezentând covalența). 





