Ozonul (trioxigen), O3, este un gaz albastru, instabil, cu un miros înțepător; este o formă alotropică a oxigenului. Ozonul e un puternic agent oxidant, cu punct de fierbere la 111,9°C. Forma lichidă a ozonului este albastru închis.
Ozonul se formează în straturile superioare ale atmosferei în urma acțiunii razelor ultraviolete asupra oxigenului. Concentrația lui maximă este la o altitudine de aproximativ 25 km. Deoarece o parte din ozonul format se descompune însă în apropierea solului, concentrația în ozon din atmosferă este foarte mică (0,1-1· 10 -6%). Cu toate acestea, ozonul are rol de protecție a naturii organice, deoarece, având mare putere de absorbție în domeniul ultraviolet, oprește o parte din radiațiile ultraviolete emise de soare (cu lungimi de undă 0,02-0,3 μ) să ajungă la suprafața pământului.
Ozonul se obține din oxigen prin intervenția unei energii dinafară: a căldurii ( de exemplu acțiunea temperaturilor înalte ale arcului electric asupra oxigenului), a electricității (descărcări electrice prin oxigen), a radiațiilor de unde scurte (iradierea oxigenului cu radiații ultraviolete, raze X) etc., care scindează molecula de oxigen în atomi și favorizează combinarea acestora cu molecule nescindate:
O + O2 → O3;  H = 34 kcal/mol
H = 34 kcal/mol
Pentru prepararea ozonului se folosește în mod obișnuit numai metoda bazată pe descărcările electrice în atmosferă de oxigen care se realizează în aparate speciale cu curent alternativ de înaltă frecvență, numite ozonizatoare (după cum e ilustrat în figura de mai jos).
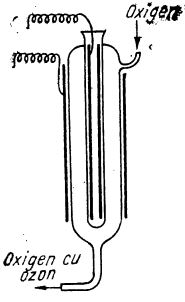 Ozonizator
Ozonizator
Unul dintre tipurile obișnuite de ozonizatoare este format din două tuburi concentrice de sticlă prevăzute cu plăci metalice. Prin spațiul dintre tuburi se trece un curent de oxigen uscat care este supus descărcărilor electrice obscure; oxigenul care iese din aparat conține până la 15% ozon. Nu se pot obține concentrații mai mari de ozon, deoarece descărcările electrice contribuie și la descompunerea ozonului format în oxigen.
Ozonul este un gaz cu miros specific, ușor de recunoscut, chiar într-o concentrație de 1 vol. ozon la 500 000 vol. aer. În cantitate mare are culoare albastră. Ozonul este mai greu decât aerul (de 1,66 ori). Se lichefiază la -111,9°C trecând într-un lichid albastru-negru; se solidifică la -251,4°C. Este solubil în apă: 100 vol. apă, la 20°C, dizolvă 45 vol. ozon (și numai 3,11 vol. oxigen).
Constatarea că ozonul se obține din oxigen, iar prin descompunere formează tot oxigen, și anume că 2 vol. ozon dau prin descompunere 3 vol. oxigen, a dus la concluzia că molecula ozonului este alcătuită din trei atomi de oxigen, O3.
Prin urmare, elementul oxigen poate exista sub forma a două substanțe simple; oxigenul (dioxigenul), O2, și ozonul (trioxigenul), O3, sunt deci modificații alotropice ale oxigenului. Ele se deosebesc prin numărul de atomi din molecule.
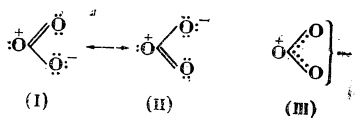
Măsurătorile de distanțe între nucleele atomilor și momentul electric au arătat că structura moleculei de ozon este simetric: cei trei atomi de oxigen sunt legați astfel încât între ei formează un unghi de 117°; legăturile între atomii de oxigen O — O sunt egale (1,2 Å), fiecare având caracter de dublă legătură.
Moleculei ozonului i se atribuie o structură intermediară (de rezonanță) între structurile limită (I) și (II):
O asemenea repartiție electronică poate fi redată și prin formula (III) care reprezintă o suprapunere a celor două structuri limită.
Momentul electric al moleculei de ozon este μ = 0,49 D.
În concentrație mare, ozonul se descompune și rezultă oxigen:
2O3 → 3O2;  H = -34 kcal/mol
H = -34 kcal/mol
Descompunerea se produce mai repede la încălzire sau în prezență de catalizatori (dioxid de mangan, dioxid de plumb, etc) sau prin iradiere cu radiații ultraviolete. Din cauza căldurii degajate și a măririi de volum care se produc în timpul descompunerii, ozonul pur este foarte exploziv.
Ozonul este un oxidant cu mult mai puternic decât oxigenul, deoarece prin descompunerea lui rezultă uneori și oxigen atomic:
O3 → O2 + O
Oxigenul atomic este foarte activ. Din această cauză, ozonul poate oxida substanțe pe care oxigenul nu le poate oxida; de exemplu, oxidează sulfura de plumb, PbS, la sulfat de plumb, PbSO4, argintul la oxid de argint, etc.
Reacția de oxidare a iodurii de potasiu, în soluție apoasă, la iod, folosește pentru identificarea ozonului:
O3 + 2KI + H2O → I2 + 2KOH + O2
Astfel, dacă în aerul ce conține ozon se introduce o bucățică de hârtie de filtru îmbibată în soluție de iodură de potasiu și amidon, aceasta se albăstrește.
Prin tratarea cu ozon a unor substanțe organice nesaturate (care conțin o dublă legătură), ozonul se adiționează la dubla legătură și rezultă ozonide.
Ozonul are acțiune energică asupra combinațiilor organice: decolorează coloranții; distruge microorganismele; eterul, alcoolul, terebentina etc. se aprind în contact cu oxigen ozonizat etc. De aceea, la experimente cu ozon nu se lucrează cu dopuri și tuburi de cauciuc, acestea fiind atacate de ozon.
Ozonul, în concentrație foarte mică, are un efect înviorător asupra organismului omenesc, îndeosebi la bolile căilor respiratorii. În concentrații mari este iritant și toxic.
Deși ozonul este un bun oxidant, totuși, având în vedere că necesită cheltuieli de fabricație foarte mari în raport cu alți oxidanți, el are un domeniu de folosire destul de restrâns. Se folosește aer ozonizat pentru dezinfectarea și dezodorizarea aerului din sălile de spectacole, spitale, vapoare etc. În unele orașe mari, sterilizarea apelor potabile se face cu ozon.
 H = 34 kcal/mol
H = 34 kcal/mol
 H = -34 kcal/mol
H = -34 kcal/mol





