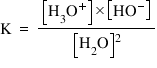pH-ul soluţiilor apoase
Partajeaza in Google Classroom

Transcript
sigur Ați observat că suntem înconjurați
de tot felul de referințe la PH
avem șampon cu PH echilibrat și
săpun și gel de duș cu PH echilibrat
și alte produse cosmetice sau de
igieni lor știu Probabil că pe
hl are legătură cu aciditatea sau
cu bazicitatea substanțelor Cică
un ph echilibrat refere la un ph
neutru egal cu 7 Dar ce reprezintă
De fapt e hazul Și de ce este notat
în acest fel și mai ales de ce
este atât de important probabil
cel mai ușor este să răspundem
la întrebarea de ce se notează
așa întotdeauna cu penix și cu
litera h mare este ușor să răspundem
la întrebarea asta tocmai pentru
că nu există un răspuns concret
nu se știe de fapt sigur De la
ce vine acel pe dinte H deoarece
chimistul Danez Sorin sorensen
care a introdus Calea de pe h nu
și a explicat odată foarte clar
raționamentul de a nota astfel
pe H Dar cum vine sigur de la hidrogen
ne ajută să ne gândim că peste
se referă la puterea ionilor de
hidrogen lucrul Ce are legătură
de altfel cu semnificația termenului
de pe H astea deoarece atât aciditatea
cât și bazicitatea soluțiilor sunt
strâns legate de existența ionilor
de hidrogen sau a protonilor în
soluție Deci ne putem gândi la
PH care au măsură a puterii sau
atât a caracterului acid sau bazic
a unei substanțe și totul se învârte
în jurul unei substanțe despre
care am vorbit și anume apa dar
înainte să discutăm iarăși despre
apă Haideți să vedem de ce atât
de important să cunoaștem și să
țină sub control nivelul pe H practic
orice proces biologic este dependent
de pe h reflectând Tanța pe hașu
lui local asupra tuturor proceselor
care au loc în celulele noastre
să luăm exemplul mioglobinei io
globina e o proteină care se găsește
în țesutul nostru musculare la
6:00 eu globina are o activitate
maximă funcționează Cel mai bine
deci mușchii noștri funcționează
foarte bine eu globina funcționează
și de la pe h5 și până la PH 7
dar dacă pe HS scade sub 5 sau
crește mai mult de 7 eu vin sa
vad natura iar mușchii noștri nu
vor mai funcționa De ce este important
ca nivelul pe HC lui să rămână
Constanța revenit la apă cred că
vă mai amintiți că am tot vorbit
despre cât de specială este apa
în general Considerăm apa ca fiind
o soluție neutră fără caracter
bazic și fără caracter acid Și
totuși apoi este conducătoare de
electricitate deși conduce foarte
puțin curentul electric asta pentru
că totuși apa conține Ion hidroniu
și Ion hidroxidul cantități foarte
mici cum știm deja Apa este un
amfolit acidobazic Deci poate funcționa
la fiecare nascent Dawn în de un
Proton unei alte molecule de apă
și transformând USA întru Ion hidroxid
sau poate funcționa ca bază acceptând
un Proton și transformând duce
întru Ion hidroniu și astfel obținem
reacția de autoprotoliza sau de
ionizare a apei această reacție
se întâmplă deoarece ocazional
au loc anumite schimbări întâmplătoare
în câmpul electric al moleculelor
de apă dacă mă mai amintiți am
zis că moleculele de apă sunt în
drum mișcare continuă rostogol
industia unele peste altele și
forma în legături de hidrogen între
ele Probabil că uneori în toți
vacarmul acelea de molecule unele
Se apropie prea tare de altele
iar hidrogenul unei molecule de
apă este atras de sarcină parțiale
negativă alte molecule de apă și
fiind foarte aproape se poate desprinde
de molecula lui și poate forma
un Ion hidroniu cu cealaltă moleculă
de aceea Apa este un amfolit poate
atât să doneze cât să își accepte
Proton această disociere a apei
este reversibil de fapt Ion hidroniu
și hidroxil vor format din nou
cele două molecule de apă în mai
puțin de o secundă Deci această
reacție de autoprotoliza are loc
chiar dacă se întâmplă atât de
rapid si Aplicând legea acțiunii
maselor asupra echilibrului reacției
de autoprotoliza obține în Constanța
de echilibru k egală cu concentrația
molară a ionilor hidroniu ori concentrația
molară a ionilor hidroxil supra
concentrația molară a apei la puterea
a doua pentru că avem două molecule
de apă în reacție Oricum un moment
dat adică un moment în care am
reușit să oprim moleculele de apă
ca intru în stop cadru și nu am
apucat să numărăm Am observat că
numai un număr foarte foarte foarte
mic de molecule sunt disociate
Ion de fapt știi cunoști foarte
bine acest număr numai o moleculă
din câteva sute de milioane de
molecule de apă în ionizează de
aceea se consideră că valoarea
concentrației molare a apei la
puterea a doua este constantă iar
produsul dintre Constanta de echilibru
a reactiei de autoprotoliza și
această constantă va fi tot o constantă
pe care o notăm cu k indice w indicele
w vinde la denumirea în engleză
a apei și anume toată această constantă
Care este egală cu produsul dintre
concentrația ionilor hidroxid și
concentrația ionilor hidroniu se
numește produsul ionic al apei
Deci pentru că e vorba de o reacție
atât de specială Constanta are
numele apro apa pură este neutră
deoarece ea conține un număr egal
de androniu și de Ion draxin care
se formează la ionizare la 25 grade
Celsius concentrația ionilor hidroniu
Care este egală cu concentrația
ionilor hidroxid este de 1 ori
10 la minus 7 moli pe litru practică
asta înseamnă că Omule cu Nadine
10 milioane este Ion hidroniu alte
molecule din alte zece milioane
este Ion hidroxi și după cum am
mai spus primește cunosc foarte
bine valoarea produsului ionic
al apei la 25 grade Celsius în
apa pură stau în soluție apoasă
produsul ionic al apei este egal
cu 1 ori 10 la minus 7 totul la
puterea a doua moli pe litru adică
este egal cu 1 ori 10 la minus
14 moli pe litru Dacă adăugăm acid
în apă pură se mărește concentrația
de Ion hidroniu pentru că produsul
ionic al apei este o constantă
Deci va rămâne tot 10 la minus
14 înseamnă că o să scadă concentrația
de Ion hidroxi din soluție Așadar
în soluțiile aside concentrația
ionilor hidroniu este mai mare
decât concentrația ionilor hidroxid
în soluțiile concentrația ionilor
hidroniu este mai mică decât concentrația
ionilor hidroxid iar în soluțiile
neutre cele două concentrații sunt
egale De aceea pentru a măsura
caracterul acid sau bazic al soluțiilor
le putem folosi în special de concentrația
ionilor hidroniu totuși există
o mică problemă aici Am văzut că
acești Ion se găsesc în concentrații
foarte foarte mici în soluții 10
la minus 7 este un număr foarte
mic este 0 000 1 Mol pe litru ca
să nu mai zic de 10 la minus 14
nu e de mirare că oamenii de știință
sau săturat de atâtea calcule de
aceea când în 1909 Sorin Sorin
sa introdus Calea de pe H aceasta
a fost primită cu brațele deschise
buna Am zis mai devreme pe hl este
o măsură pentru Tăria bazicitatii
sau acidității soluțiilor apoase
Dar cum anume putem ajunge să măsurăm
asta rolul principal este jucat
în realitate nu de Ioni de hidrogen
și de Ioni hidroniu dar atunci
de mult Acum mai bine de 100 de
ani Când se introduc scara de pe
H stai introdus și această simplificare
nu neapărat corectă pentru că noi
știm acum că Ioni de hidrogen sau
protonii nu există în stare liberă
în soluție definiția matematică
a lui este aceasta pe altul este
egal cu minus logaritm zecimal
din concentrația ionilor de hidrogen
existenți în soluție sau mai corespund
din concentrația ionilor hidroniu
probabil deja vă uitați la definiție
dar nu este cazul oamenii de știință
sunt foarte buni prieteni cu logaritm
poate că unii dintre voi voi nu
ați ajuns încă la matematică la
capitolul calugarii nu e nicio
problemă Ba Din contră o să vă
ajută foarte mult pe viitor la
matematică faptul că voi deja veți
întâlni cu logaritmul zecimal sau
i se mai spune logaritm în baza
10 știind că în apa pură la 25
grade Celsius sau determinat o
concentrație de Ion hidroniu de
1 ori 10 la minus șapte moli pe
litru acest minus 7 reprezintă
logaritmul nostru zecimal eliminăm
semnul minus și obținem pe hl7
Deci logaritmul este de fapt exponentul
puterii la care trebuie ridicat
un alt număr în baza pentru a se
obține numărul dat poate vă pare
complicat Dar este foarte foarte
simplu logaritmul în baza 10 din
x este egal cu y logaritm în baza
10 se mai Notează pe scurt LG că
e foarte des utilizat și e mult
mai simplu De notat așa deci logaritm
zecimal din 100 este egal cu 2
asta pentru că 10 la puterea a
doua este egal cu 100 sau logaritm
zecimal din 0 este egal cu minus
unu asta pentru că 10 la puterea
minus 1 este egal cu 0 pe el apei
Pure este egal cu minus logaritm
din concentrația ionilor de hidrogen
sau mă rog de hidroniu adică este
egal cu un minor și logaritm din
unu ori 10 la minus șapte și obținem
astfel un pe H egal cu 7 și dacă
tot nu va convins că logaritmul
zecimal este putem să definim pe
hol în acest fel concentrația de
Ion hidroniu este egală cu 10 la
minus pe H de aici pe hl unei soluții
este egal cu puterea cu sambata
concentrație ai anilor de hidroniu
dintre o soluție de exemplu o soluție
în care concentrația ionilor hidroniu
este 0 moli pe litru va avea pe
H egal cu 1 Deci concentrația ionilor
de hidroniu este egal cu 10 la
puterea minus 1 moli pe litru este
h l este egal cu puterea Cum se
schimbata concentrației de cu plus
1 ori revenit la Apa pură concentrația
ionilor hidroniu este egală cu
1 ori 10 la minus șapte și pe hazul
este egal cu 7 iar aceasta valoare
pe h a lui apei Pure este baza
escalei de pe H pe h este 7 Deci
se află la mijlocul scale soluțiile
cu pH mai mic decât 7 sunt acizi
iar soluțiile cu pH mai mare decât
7 sunt bani legat de Scala de pe
h foarte important să ținem Minte
că pe hl este calculat dintre un
logaritm negativ e vorba de Acel
minus din definiția matematică
apeh asta înseamnă că lucrurile
stau puțin pe dos când crește concentrația
de Ion hidrogeni dintre o soluție
phn scade iar când concentrația
de Ion de hidrogen din soluție
Scade crește Avem apă pură cu concentrația
de Ion de hidrogen egală cu 1 ori
10 la minus 7 adică egal cu 0 moli
pe litru Și de aici cu pe hl7 Dacă
adăugăm în apă un acid precum sucul
de lămâie concentrația de Ion de
hidrogen crește la 1 ori 10 la
minus 3 moli pe litru adică este
egală cu 0 moli pe litru și rezultă
că pe hazul este egal cu 3 de vedem
că avem o concentrație de Ion androne
you de 10.000 de ori mai mare decât
în cazul precedent dar pe H la
scăzut Pe de altă parte pornind
tot de la o soluție de apă pură
Dacă adăugăm o bază în apă precum
amoniacul aceasta ar consuma Ioni
de hidrogen existenți în apă și
atunci concentrația de Ion hidroniu
Poate să scadă până la unu ori
10 la minus 11 moli pe litru ceea
ce înseamnă un număr cu multe multe
zerouri după virgulă și corespunde
unui pe H egal cu 11 concentrația
de Ion hidroniu este de 1000 de
ori mai mică decât în cazul apei
dar pe hl este mai mare Așadar
vedem că de fapt logaritmi sunt
prietenii noștri pentru că ne ajută
foarte mult atunci când trebuie
să lucrăm cu numere foarte foarte
sau cu numere foarte mari Calea
de PH cuprinde valori de la 0 la
14:00 cu numerele între zero și
șapte reprezentând acizi și cu
numerele între 7 și 14 reprezentând
bazele acizii tare după cum am
mai zis lecția trecută ionizează
complet Deci donează foarte rapid
mulți androgeni căzând imediat
pe hl unei soluții ezitare au în
general pe H parte a scăzut la
ce Zi la Adi că are disociază incomplet
eliberează mai puțini unde hidrogen
De ce valori ale pe H lui de la
4:00 la 6:00 bazele tari precum
hidroxidul de sodiu consumă foarte
mulți ani de hidrogen din soluție
În consecință concentrația de Ion
de hidrogen scade deci pe H bazelor
tari bas foarte ridicat bazele
a b precum bicarbonatul de sodiu
consumă mai puțin Ion de hidrogen
și au de obicei un pe Haș între
8 și 11 Teoretic ph neutru este
7 o să practic sunt considerate
soluții neutre soluțiile care au
pe hl între șase și opt pentru
foarte multe procese chimice este
foarte important să se cunoască
valoare pe h a lui soluțiilor mai
ales procesele biochimice au loc
la valori bine determinate ale
pe h în laborator valoarea aproximativă
a pe hașu lui soluțiilor poate
fi determinată cu ajutorul hârtiei
indicatoare de PH aceasta se colorează
diferit pentru diferite valori
ale pe Haș când este vorba de pe
h în anumite cărți de chimie sau
culegeri de probleme autorii Notează
concentrația ionilor hidroniu ca
și cum ar fi concentrația ionilor
de hidrogen este o simplificare
și sunt considerate corecte amândouă
notațiile Trebuie doar să ținem
noi Minte că Ioni de hidrogen nu
există liberi în soluție ce de
obicei e sub formă de Ion hidroniu
stau atașate de alte molecule Până
acum am văzut cât de important
este să putem monitoriza transferul
de protoni în reacțiile acidobazice
începând cu lecția viitoare ia
și transferul de electroni Deci
vom vorbi despre reacțiile de oxidoreducere

 H3O+ + HO-
H3O+ + HO-