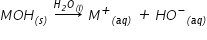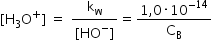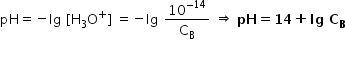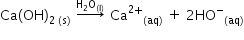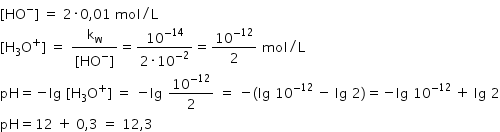pH-ul soluțiilor apoase de baze tari
Tag-uri
Partajeaza in Google Classroom

Transcript
atunci când ionizează în apă bazele
formează Ioni hidroxil Cât de mulți
ani draxin vor fi în soluție apoasă
de bază de pinde detaliat bazei
lucrurile sunt foarte clare în
cazul bazelor monoprotice tari
la fel ca în cazul acizilor și
bazele monoprotice sunt cele care
ionizează întru singură treabă
bazele tari după cum bine știi
sunt cele care ionizează complet
în apă Deci concentrația ionilor
hidroxil este egală cu concentrația
bazei trei exemple pentru o soluție
de hidroxid de sodiu 1 mă dar se
găsește de fapt o concentrația
ionilor de sodiu egală cu concentrația
inelului hidroxil și egală cu un
Mol pe litru pentru a calcula pe
H lunea astfel de soluții aflăm
concentrația ionilor hidroniu din
soluție și acest lucru este foarte
simplu datorită produsului ionic
al apei Care este egal cu produsul
dintre concentrațiile molare ale
ionilor hidroniu și ionilor hidroxil
și care la 25 grade Celsius are
o valoare de 10 la minus 14 moli
pe litru la puterea a doua de această
valoare este pentru o temperatură
de 25 de grade Celsius din această
relație de ducem când concentrația
ionilor hidroniu este egală cu
produsul ionic al apei supra a
concentrația molară A ionilor hidroxil
dar în cazul soluției noastre de
hidroxid de sodiu 1 molar această
concentrația ionilor hidroniu este
egală cu 10 la minus 14 supra concentrația
bazei adică un număr natural concentrația
ionilor hidroniu egală cu 10 la
minus 10 moli pe litru iar pe hazul
este egal cu minus logaritm zecimal
din concentrația ionilor hidroniu
de ce este egal cu minus logaritm
zecimal din 10 la minus 14 Așadar
soluția noastră are pe h14 iar
relația generală pentru a afla
netul relațiile generale pentru
soluțiile de baze tari sunt acestea
în centru rația ionilor hidroniu
este egală cu produsul ionic al
apei supra concentrația bazei de
unde rezultă că pe hazul este egal
cu minus logaritm zecimal din 10
la minus 14 supra concentrația
bazei Deci Putem afla pe hl unei
soluții de baze tari folosind direct
relația 14 plus logaritm zecimal
din concentrația bazei Haide să
calculăm pe hl unei soluții de
hidroxid de sodiu 0 molar de această
dată cum sint rația ionilor hidroxil
este egală cu concentrația bazei
adică cu 0 moli pe litru iar concentrația
ionilor hidroniu este egală cu
produsul ionic al apei supra concentrația
ionilor hidroxil 10 este egală
cu 10 la minus 14 supra 0 este egală
în continuare cu 10 la minus 12
moli pe litru pe h a soluției este
egal cu minus logaritm din 10 la
minus 12 este egal în continuare
cu 12 sau pentru aceeași soluție
putem aplica formula am pe H egal
cu 14 Plus yoga rece din concentrația
bazei înlocuim valoare concentrație
aici și obținem 14 plus logaritm
din 10 la minus doi și este egal
tot cu 12 în schimb dacă vrea să
calculăm pe hl unei soluții de
hidroxid de calciu să zicem că
avem o soluție de hidroxid de calciu
tot 0 molar nu putem aplica această
formulă deoarece în cazul hidroxidului
de calciu la ionizarea completă
în apă se formează doi Ioni hidroxil
Deci când calculăm pe hazul soluției
trebuie să ținem cont de faptul
că ai aici Avem doi Ion de hidroxil
astfel în centru rația ionilor
hidroxil este egală cu 2 ore 0 și
este egală cu 2 ori 10 la minus
2 moli pe litru află concentrația
ionilor hidroniu avem valoare a
produsului ionic al apei supra
concentrația ionilor hidroxil Deci
concentrația ionilor hidroniu este
egală cu 10 la minus 12 supra 2
moli pe litru și pe HCL acestei
soluții este egal cu minus logaritm
zecimal din concentrația ionilor
hidroniu Deci din 10 la minus 12
supra 2 efectuând calculul matematic
și obținem un ph de 12