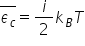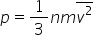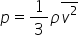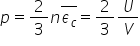Principiul echipartiţiei energiei. Formula fundamentală.
Tag-uri
Partajeaza in Google Classroom

Transcript
În ce dată a lecției de termodinamică
vom discuta despre teoria cinetico
molecular dureri cinetică moleculară
are la bază așa numit un model
al gazului deal un model este în
general o serie de mărimi și relații
între mărimi folosite pentru a
descrie un sistem real care nu
duc această descriere până la capăt
de cinste simplificată dar totuși
de de scriere corectă a fenomenelor
ce se doresc a fi studiate durerea
cinetico moleculară și modelul
gazului de el de la baza ei sunt
construite pe baza ipotezei atomice
despre care am discutat în prima
lecții de termodinamică modelul
gazului ideal în mod concret pornește
de la următoarele patru ipoteze
sau noțiuni de bază prima este
că numărul de atomi sau molecule
din gaz nu este foarte mare și
că acest și că aceste molecule
sau atomi sunt identici 2-a este
că dimensiunile atomilor sau moleculelor
sunt neglijabile față de distanțele
dintre ele altfel spus putem considera
atomii sau moleculele puncte materiale
de dimensiuni 0 a treia presupunere
sau simplificare este că nu avem
interacțiuni între atomii sau moleculele
gazului singurele modalități de
interacțiune dintre atunci sau
molecule fiind ciocnirile care
sunt considerate perfect elastici
altfel de interacțiuni sunt neglijate
și ultima presupunere este că mișcarea
atomilor sau moleculelor dintre
un gaz ideal este continuăm haotică
adică nu există o direcție preferențială
de mișcare Direcția de mișcare
este ale aleatorie și că ea are
loc pe traiectoriei rectilinii
între aceste ciocniri aceste noțiuni
sau presupuneri care stă la baza
a modelului gazului de el au la
bază măsurători precum cele efectuate
de brown și care au dus la noțiunea
de mișcare browniană care sunt
prezentate în această imagine Deci
ceea ce vedeți aici este înregistrarea
mișcării unei particule de polen
aflată în suspensie între un lichid
și ceea ce vedem este că particula
mișcare întradevăr aleatorie continuă
și haotică că între două ciocniri
ale particulei cu atomii sau molecule
lichidului traiectoria este rectilinie
și că între adevăr în afară de
aceste ciocniri care modifică traiectoria
particulei se pare că nu mai există
alte interacțiuni semnificative
pentru că aceste tractorist sunt
drepte pe baza modelului gazului
ideal se stabilește următorul principiu
pe care îl voi formula și apoi
voi explica un pic Deci principiul
echipartitiei energiei pe grade
de libertate acest principiu spune
că energia cinetică medie a unui
atom sau molecule din tu un caz
egal distribuită pe fiecare grad
de libertate și egală cu produsul
dintre Constanța boltzmann și temperatura
absolută împărțită la 2 scris sub
formă de ecuație acest principiu
spune că din nou energia cinetică
medie Asta înseamnă nu Imediat
cinetică a unei molecule sau unui
atom și media tuturor energiilor
cinetice este egală cu raportul
dintre numărul de grade de libertate
pe care voi defini mediat a împărțit
la 2 înmulțit cu produsul dintre
Constanța boltzmann și temperatura
Deci este numărul de grade de libertate
iar prin definiție un grad de libertate
este o coordonată independenta
mișcării bun Acum să îi stricăm
un pic acest principiu și mărimile
prin care este El este formulat
În primul rând acest principiu
este de fapt măsură este de fapt
demonstrat nici ecuația aferentă
lui este demonstrată în fizică
statistică dar Acesta este un domeniu
al fizicii studiată mult mai târziu
în particular în facultate totuși
Noi luăm ca punct de plecare pentru
dezvoltarea teoriei cinetico moleculare
aceste rezultate a fizicii statistice
pe care o formulăm ca și principii
adică fără Demonstrați dar e important
să știți că el poate fi demonstrat
și el spune din nou că energia
cinetică medie adică mișcarea dacă
vreți mișcarea unei a unui atom
sau molecule nu are direcție preferențial
ceea ce este legat direct cu ipoteza
sau nu țiunea de bază numărul 4
din modelul gazului ideal acesta
spune că mișcarea este haotică
ceea ce înseamnă că dacă consider
Spre exemplu în acest experiment
axa x sau xy avem trei trei coordonate
pentru a descrie mișcarea avem
nevoie de coordonatele x y și z
Deci în cazul simplu al atomului
din modelul gazului de el și anume
un atom sau moleculă punctiform
cu dimensiuni neglijabile atunci
singura mișcare de translație care
este descrisă de trei coordonate
în concluzie pentru a putea Scrie
forma finală a energiei cinetice
medie a unei molecule în gazul
ideal folosim această ipoteză a
modelului gazului ideal cu numărul
2 și anume că dimensiunile sunt
neglijabile ceea ce după cum am
spus implică că numărul de grade
de libertate este trei care corespund
celor trei coordonate carteziene
x y și z ca și comentariu dacă
atomul sau molecula ar avea dimensiuni
neglijabile adică nu ar fi punctiform
atunci numărul de grade de libertate
a crește pentru că Spre exemplu
pe lângă translație mișcare de
translație o moleculă cu dimensiuni
poate avea și o mișcare de rotație
în jurul axului propriu acele sunt
coordonate reparate coordonate
de mișcare separate față de cele
translație sunt coordonate unghiulare
de rotație și atunci am avea un
număr de grade de libertate Spre
exemplu 5 dacă includem doar rotația
dar revenind în cazul modelului
nostru cel al gazului ideal numărul
de grade de libertate este trei
și Deci energia cinetică medie
pe moleculă sau pe atom este 3
împărțit la 2 capete Constanța
lui boltzmann a fost introdusă
și definită în lecția precedentă
ei este egală cu raportul dintre
Constanța universală sau Constanta
Maier aer și numărul lui avogadro
na Deci cine genetică medie se
va scrie ca fiind 3 pe 2 iar împărțit
la a înmulțit cu temperatura prin
definiție energia cinetică medie
este suma tuturor energiilor cinetice
în Deci o sumă de la 1 la n unde
n este numărul de atomi sau molecule
Deci facem suma tuturor energiilor
cinetice ale moleculelor și împărțit
la numărul de atomi sau molecule
Asta e definiția unei medii în
general aceasta se poate scrie
în mod Evident ca unul pe an sumă
din nou pe pentru toate moleculele
sau Tomi din masă unui atunci sau
moleculă masita cu viteza lui la
pătrat împărțită la 2 din nou am
considerat că în ipoteza numărul
unu în modelul gazul ideal Cămașa
este că Masa este aceeași Deci
atomi sau molecule sunt identici
deci putem scrie că este egal cu
m împărțit la 2 1 pe an sumă după
egal pentru e de la 1 la n din
z pătrat care prin definiție este
viteza la pătrat media vitezei
la pătrat comentariu ca și comentariu
pătratul mediei nu este media pătratului
puteți să Verificați singuri din
definiția mediei dar aceasta este
un alt fel de a spune că pătratul
unei sume nu este suma pătratelor
Din ce e aceste Două ecuații rezultă
că 1 pe 2 m z pătrat medium este
egal cu 3 pe 2 împărțit la n a
înmulțit cu temperatura absolută
adică r t este egal cu 1 pe 3 n
a m z pătrat meci media pătratului
viteze din ecuație generală a gazelor
știind că este egal cu un r t Deci
obținem că pev este egal cu 1 pe
3 nu numarul de kilomoli or an
a numărul lui avogadro înmulțit
cu m v pătrat mediu dar nu înmulțit
cu n a este prin definiție numărul
total de moli de atomi sau molecule
iar m împărțit la V este densitatea
prin definiție densitatea de scuzați
n1mm densitatea de atomi sau molecule
de ce obținem că pe este egal cu
1 pe 3 în munți cu l densitatea
de atomi sau molecule înmulțită
cu masa unei unui atom sau în memorie
cu rama cu media viteze la pătrat
aceasta este formula fundamentală
a teoriei cinetico moleculare ea
are forme echivalente Deci formula
fundamentală a teoriei circulare
pe care îmi dăduse este aceasta
are forme echivalente Spre exemplu
Ținând cont că densitatea gazului
este prin definiție Masa lui împărțită
la volum adică este egală cu numărul
de atomi sau molecule un sita cu
masa unui a unei atunci a murit
curent pățit la avea de ce este
egal cu densitatea de numărul de
atomi sau molecule pe unitatea
de volumul cu masa unuia înlocuind
în prima formulă obținem că presiunea
este unul pe trei muncitori cu
densitatea volumului înmulțită
cu media pătratului vitezei de
asemeni putem scrie că e n m v
pătrat mediu este egal cu 2n energia
cinetică medie în această relație
este evidentă iar energia cinetică
medie este prin definiție energia
totală internă a gazului împărțită
la volum energia totală a gazului
care se numește ninge internă și
se notează cu va fi produsul dintre
volum și energia cinetică medie
a unei molecule de aici obținem
o altă formulă altă formulare a
formulei fundamentale și anume
că presiunea este egal cu 2 pe
3 numărul înmulțit cu numărul de
molecule pe unitatea de volum înmulțită
cu energia cinetică medie sau egal
cu 2 pe 3 muncitor cu energia totală
internă a gazului împărțită la
volumul