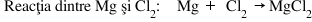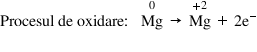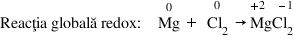Reacţii redox. Oxidanţi şi reducători.
Partajeaza in Google Classroom

Transcript
viața noastră de zi cu zi e dependentă
De reacțiile de oxidoreducere la
fel și industria și Progresul Tehnologic
în telecomunicații sau transport
atunci când călătorim deplasarea
noastră se datorează reacțiilor
De oxidoreducere ce au loc odată
cu arderea combustibilului electroni
se transferă de la o specie la
alta iar în timpul acestui proces
roțile vehiculului nostru și noi
mergem tot mai departe ia zile
din bateriile telefoanelor laptopurilor
sau tabletelor voastre sau din
bateriile oricăror aparate electronice
portabile sunt toate reducere coroziunea
metalelor este tot rezultatul unor
astfel de reacții metabolismul
nostru este condus de reacții de
oxidoreducere Deci gândurile noastre
și activitățile noastre identic
cu zi au loc numai datorită migrări
electronilor de la mâncare pe care
o ingerăm până la oxigenul pe care
le Skizzo cred că degeaba îți dai
seama că despre care urmează să
vorbim implică transferul uneia
dintre cele mai mici particule
fundamentale și anume electronul
am discutat capitolul trecut despre
una dintre cele mai importante
categorii de reacții chimice și
anume reacțiile dintre acizi și
baze care au loc prin transferul
unei alte particule fundamentale
adică Deci principiul transferului
unei particule de la 108 la alta
ne este familiar pentru început
putem să ne gândim că la baza reacțiilor
de oxidare și reducere stă ideea
principală a multor sporturi fotbal
baschet baseball sau biliard principal
este de a face un obiect adică
mingea să se miște întru anume
locație așa dar atunci când chimiștii
amestecă agită Sau ieri câte ceva
tot ceea ce faci este să încurajezi
anumite particule fundamentale
în acest caz de electroni iar în
cazul capitolului trecut protoni
de acolo de unde se găsesc acolo
Unde vor chimiștii ca aceste particule
să ajung industria face același
lucru Doar că la o scală mult mai
mare inițial procesul de oxidare
a fost definit ca fiind reacția
oxigenului cu un element prin care
elementul se transformă în operația
de oxidare a magneziului duce la
formarea oxidului de magneziu reacția
inversă de obținere a metalului
din oxidul său a fost definită
ca fiind proces de reducere de
exemplu reacția de obținere a magneziului
din oxidul de magneziu este o reacție
de reducere a oxidului de magneziu
însă ulterior aceste definiții
au căpătat un sens mult mai larg
Spre exemplu este considerată ca
fiind reacția de oxidare și reacția
dintre magneziu și clor chiar dacă
aceasta nu implică prezența oxigenului
apelul reducerea clorurii de cupru
cu hidrogen este considerată o
reacție de reducere deși cuprul
este obținut din clorură și nu
Din tronox Toate aceste reacții
cât și procesele despre care am
pomenit la începutul lecției sunt
consecințe ale transferului de
electroni de la o specie chimică
la alta atât în cadrul oxidării
cât și în cazul reducerii sunt
atomi care se lasă târât sau transportați
alături de electronul care migrează
însă Oricum ar fi cu aceștia tone
procesul fundamental care are loc
este transferul de electroni de
la ceea ce se oxidează la ceea
ce se reduce mesajul principal
pe care trebuie să le ținem neapărat
este următorul oxidarea este cedare
de Electra reducerea este acceptare
de electroni 9 limba română ne
vine foarte mult un ajutor în acest
caz pentru a putea reține semnificațiile
acestora e de ajuns să ne uităm
cu atenție la felul în care sunt
formate cele două cuvinte oxidare
și reducere oxidare conține în
structura lui dar A deci clar Mega
din căldare specia chimică care
se oxidează de electroni cuvântul
reducere conține structura lui
cuvântul cere Deci specia chimică
care se reduce cere electron Deci
clar atunci când i se oferă Ba
accepta electronic fără prea multe
discuții pentru a putea da o definiție
și mai cuprinzătoare a acestor
procese trebuie să ne reamintim
mai întâi Ce este numărul de oxidare
numărul reprezintă o definire mai
Generale a valenței care include
atât Electro valențele pozitivă
și negativă ce se referă la transferul
de electroni cât și cu valența
care se referă la punerea în comun
de electroni Deci numărul de oxidare
ale unui atom reprezintă o sarcină
pe care el ar putea să o aibă Teoretic
un compas am mai discutat în lecția
dedicată numerelor de oxidare și
despre regulile pentru stabilirea
numerelor de oxidare așa dar acum
putem defini astfel reacțiile de
oxidare și de a reduce reacția
de oxidare este procesul în care
o specie chimică cedează electroni
iar numărul de oxidare al unui
element din aceasta va crește reacția
de reducere este procesul în care
o specie chimică accepte electroni
iar numărul de oxidare al unui
element din această Ciucă scade
Deci se reduce Haideți să ne uităm
la altele de mai devreme în cazul
reacției dintre oxigen și magneziu
observăm că numărul de oxidare
al magneziului a crescut de la
zero la plus 2 magneziul a cedat
doi electroni oxigenului de spunem
că magneziul sau ce Da la fel și
reacția dintre magneziu și clor
magneziul este oxidat dar magneziu
plus 2 Elsei din de data aceasta
a doi electroni celor doi atomi
de clor în cazul reacției dintre
oxidul de magneziu și carbon observăm
că numărul de oxidare al magneziului
scade de la plus 2 la 0 magneziul
acceptat doi electroni și de aceea
scade și numărul de oxidare Deci
spunem că în acest caz magneziul
sare dus la fel și reacția dintre
clorura de cupru și hidrogen cuprul
este redus de la 1 plus 2 la cupru
de la fel ca protoni electroni
nu existai libere în mediul de
reacție Deci are loc un transfer
de electroni de la o specie chimică
la alta când o specie Dinică cedează
electroni înseamnă că ea se găsește
în prezența altei specii chimice
care e capabilă Să accepte acest
electroni de aceea nu pot exista
Independent numai reacții de oxidare
care stau numai reacții de reducere
si intotdeauna au loc reacții care
cuprind ambele procese adică au
loc reacții de oxidoreducere sau
mai pe scurt reacțiile tu pe scurt
Ansamblul proceselor de oxidare
și reducere constituie reacția
redox Haideți să revenim acum la
reacția dintre magneziu și clor
în prezența clorului fiecare atom
de magneziu cedează câte doi electroni
și Formează câte un Ion magneziu
2 acesta fiind un proces de oxidare
Deci numărul de oxidare al magneziului
crește de la zero la plus atomi
de clor se transformă în Ioni Lore
minus prin acceptare a câte unui
electron de către fiecare atom
de clor acesta fiind un proces
de reducere Deci numărul de oxidare
al clorului scade de la Z zero
la mie astfel vedem că de fapt
Este vorba doar de transfer de
electroni electronice dat de atomi
de magneziu sunt transferați la
atomi de clor ecuația reacției
globale se obține prin însumarea
celor Două ecuații de oxidare respectiv
de reducere astfel ca numărul electronilor
cedați de magneziu să fie egal
cu numărul electronilor acceptați
de clor așa dar e foarte important
să reținem că în reacție cu transfer
de electroni un atom cedează electroni
adică se oxidează și urato mă accepte
electron adică se reduce numărul
electronilor cedați în procesul
de oxidare este întotdeauna egal
cu un numărul electronilor acceptați
în procesul de reducere pe cea
chimică din care face parte a atomului
sau ionul care acceptă electroni
se numește oxidant adică specie
a care se reduce este Oxi iar substanța
care conține special oxidant se
numește agent oxidant când între
un amestec de reacție există o
specie chimică Care dorește să
primească electroni Care este poate
reduce această specie chimică poate
genera au oxidare a unei alte specii
chimice care are De unde să îi
cedez Electro de acolo denumirea
de agent oxidant deși substanța
respectivă se reduce la fel specia
chimică din care face parte atomul
sau ionul care între o reacție
cu transfer de electroni cedează
electroni se numește reducător
adică specia care se oxidează este
reducător iar substanța în care
există speciale tocător se numește
agent reducător asta deși respectivă
se oxidează în același timp ia
generează reducerea unei Iași de
specii chimice care va primi electroni
pentru a obține anumite substanțe
chimiștii au nevoie de agent reducă
urșii de agenti oxidanti la modul
general agenții oxidanți sunt compuse
și a unor elemente cu numere de
oxidare mari Deci sunt bune oxidanți
următorii compuși acizii oxigenați
ai nemetalelor precum acidul azotic
acidul sulfuric concentrat sau
acidul percloric mai sunt bună
și compușii metalelor tranziționale
în care acestea au numere de oxidare
mari permanganatul de potasiu dioxidul
de mangan sau dicromatul de potasiu
să vedem și care sunt numerele
de oxidare ale elementelor din
acești compuși să ne reamintim
că printre regulile pentru stabilirea
numerelor de oxidare este și o
regulă care spune că suma algebrică
a numerelor de oxidare ale tuturor
elementelor componente ale compusului
este egală cu zero știind că oxigenul
are în gen numărul de oxidare minus
2 iar potasiu plus 1 Deci după
un calcul matematic simplu vedem
că în permanganatul de potasiu
manganul are numărul de oxidare
Galșa în dioxidul de mangan numărul
de oxidare al manganului este plus
4 iar în model de potasiu vedem
că numărul de oxidare al cromului
este plus Așadar neam rămurică
întradevăr în acest compuși Metalele
tranziționale au numere de oxidare
mari agenții oxidanți un cot ionii
metalelor puțin active cupru 2
plus și în special a e metalelor
nobile argint lui sau our trecut
asta deoarece acești cationii au
tendința de a reduce cu ușurință
prin electronii oxidare bun mai
sunt și unele substanțe elementare
respectiv elementele cu electronegativitate
mare oxigenul fluorul sau bromul
drept agent reducător e sunt utilizate
de obicei substanțele care se oxidează
adică cedează electroni cu ușurință
acestea sunt Metalele care au un
caracter electronegativ foarte
slab adică potasiul sodiul magneziul
calciul mai sunt și unele nemetale
precum hidrogenul și carbonul dar
și unii oxizi ai nemetalelor cu
numere de oxidare mici precum monoxidul
de carbon care carbonul are numărul
de oxidare plus doi agent reducător
buni sunt și unii hidracizi precum
acidul clorhidric acidul bromhidric
acidul iodhidric sau hidrogenul
sulfurat utilizator și cationii
metalici cu numere de oxidare mici
după cum am văzut Chiar mai devreme
în cazul mangal lui există și elemente
care pot avea mai multe numere
de oxidare în aceste cazuri compuși
acestor elemente pot avea caracter
oxidant atunci când elementul are
număr de oxidare maxim pot avea
caracter oxidant și reducător când
elementul are număr de oxidare
intermediar sau mai pot avea caracter
reducător când elementul are număr
de oxidare Minnie și tot mai devreme
când vorbeam despre agenții oxidanți
am pomenit și despre metale mai
puțin activ sau metale in activitatile
au fost ordonate în funcție de
caracterul oxidul reducător între
o ordinea nume numită seria activității
metalelor ordonare a fost făcută
pe baza a rezultatelor experimentale
Metalele de la începutul seriei
au tendința mai mare de a ceda
electron Ele au un caracter reducător
mai accentuat în special vedem
că sunt foarte active Metalele
alcaline și Metalele alcaline o
pământul după hidrogen sunt situate
Metalele care au o tendință mai
mică de a ceda electroni acestea
au un caracter reducător mai este
lecția viitoare vom vedea Cum ne
putem ajuta de seria activității
metalelor pentru a putea prezice
care vor fi produșii de reacție
în anumite reacții de substituție
așadar am văzut în această lecție
Ce presupune transferul de electroni
e foarte important să reținem că
oxidarea este cedare de electroni
iar reducerea este acceptare de
electroni tu lecția viitoare vom
vedea și cum putem stabili cu eficienți
stoechiometrici în ecuațiile reacțiilor
redox