Soluţii. Dizolvarea compuşilor ionici şi moleculari în apă.
Partajeaza in Google Classroom

Transcript
aerul apa mărilor și oceanelor
laptele și sângele și sucurile
și ciorbă pe care o mâncăm la prânz
toate sunt soluții Deci cum toate
gazele și lichidele cu care venim
în contact sunt soluții practic
corpul nostru funcționează numai
datorită soluțiilor pe care le
conțin Dar ce sunt de fapt soluțiile
soluțiile sunt amestecuri omogene
formate din două sau mai multe
substanțe substanțele Se pot amesteca
indiferent de starea lor de agregare
Ele pot fi gaze solide sau lichide
de exemplu dacă un pahar cu apă
punem niște să zicem niște agrafa
de birou metalice și în alt pahar
cu apă punem sare dintre o solniță
și agităm conținutul celor două
pahare obținem două amestecuri
dorca dintre aceste două amestecuri
numai unul este omogen și Deci
o soluție în pahar în cu agrafele
de birou acestea încă sunt acolo
nu Sau dizolvat iar în cazul paharului
în care am pus sare a vedem că
sarea dispărut Deci se dizolvă
primul amestec este un amestec
eterogen după amestecare încă putem
distinge foarte clar cele două
substanțe apa și Metalul care formează
agrafele al doilea amestec este
un amestec omogen amestecurile
omogene apare atunci când două
sau chiar și mai multe substanțe
se amestecă atât de bine încât
părea a fi devenit una singura
adică Există o singură fază si
astfel iau naștere soluțiile când
ne gândim la soluții trebuie să
ne vină în minte Imediat două noțiuni
foarte foarte importante fiind
care se formează de faptul soluție
ce anume solventul sau dizolvantul
5 solutul sau solvatul sau substanță
dizolvată solventul sau dizolvantul
este substanța care se află în
cantitate mai mare ce făcu ne dăm
seama Și după denumire este substanța
care dizolvă ceva Ce anume dizolvă
solutul sau solvatul Deci substanța
care se află în cantitate mai mică
este solutul solvatul sau substanță
dizolvată denumirea de soluție
mai scurtă așa că mai departe o
voi folosi pe aceasta un solvent
poate dizolva mai multe soluții
în același timp dacă în paharul
cu apă de mai devreme în care am
pus sare Am adăuga și zahăr observat
că și aceasta se va dizolva o soluție
se obține prin procesul de dizolvare
a soluțiilor în solvenți Deci la
amestecarea a sării cu apă a avut
loc da Valea Sării în apă și formarea
soluției apoase de sare Apa este
de solventul sau dizolvantul iar
Sarea este solutul când e vorba
de soluții cel mai mult ne gândim
la soluții în lichide de exemplu
apa de mare e o soluție lichidă
în care se găsesc dizolvate peste
60 de soluții există și soluții
gazoase chiar atmosfera Pământului
este o soluție gazoasă pentru că
aerul e format din aproape 79%
le considerați solventul iar oxigenul
dioxidul de carbon și celelalte
Gaze din aer sunt considerate soluții
există și soluții solide cum ar
fi aliajele aliajele reprezintă
soluția a unui metal între un alt
metal bronzul Spre exemplu e o
soluție de zinc în cupru după cum
am văzut mai devreme nu toate substanțele
se pot dizolva pentru a forma amestecuri
omogene proprietatea unei substanțe
de a se dizolva în altă substanță
se numește solubilitate solubilitatea
se referă la Cantitatea maximă
de soluție se va dizolva pentru
anume cantitate de solvenți la
anumite condiții de temperatură
și presiune tu convinsă că știi
din propria voastră experiență
că este o limită la cât de mult
soluții poate fi dizolvat între
o cantitate dată de sol Deni dacă
spus vreodată prea mult zahăr în
limonada cu gheață o parte din
miere au rămas sigur nedizolvat
pe fundul paharului Oricât de mult
va chinui să îl amestecați motivul
este că zahărul și atingi solubilitatea
maximă în apă la temperatura respectivă
Dacă aș fi încălzi limonada Da
Ruse ar fi dizolvat imediat solubilitatea
depinde de aici de temperatură
o să notez în continuare solubilitatea
cu litera s mare pentru solidele
care se dizolvă în lichide solubilitatea
crește de obicei odată cu creșterea
temperaturii în cazul gazelor lucrurile
stau exact pe dos solubilitatea
scade odată cu creșterea temperaturii
de exemplu oxigenului care se dizolvă
în apă unui lac îi scade solubilitatea
Pe măsură ce temperatura crește
de cinci zilele caniculare de vara
peștii din lacuri au întotdeauna
de suferit în cazul gazelor solubilitatea
depinde și de presiune și este
un al treilea Factor foarte important
De care depinde solubilitatea ce
anume natura solventul natura solventului
determină tipul legăturilor chimice
care se vor forma a între particulele
de soluții solvenți lecțiile trecute
am vorbit destul de mult despre
apă așa că Sigur vă reamintiți
că apa este un solvent extraordinari
Apa este formată din molecule polare
între care stau stabili legături
de hidrogen în apă sunt solubili
compușii ionici și substanțele
care au structură asemănătoare
cu a apei adică cele care pot forma
legături de hidrogen cu moleculele
apei sau care au molecule polare
Așadar în apă se dizolvă substanțe
ionice substanțe ionice precum
clorura de sodiu sulfatul de cupru
sau dioxidul de sodiu si inapoi
mai dizolvă și substanțe care pot
forma legături de hidrogen cu apa
cum e cazul amoniacului cazul acidului
clorhidric sau altarului și a multor
alte substanțe Bun deci adăugăm
noi o cantitate de sare în drum
volum de apă și vedem că va deveni
în curând o soluție omogenă Dar
ce se întâmplă de fapt la nivel
molecular în timpul dizolvării
dizolvarea este un fenomen fizic
ea nu are loc pur și simplu în
procesul de dizolvare particulele
de solut difuzează printre moleculele
de soluție acela amestec omogen
Dar ce e foarte important e că
în același timp cu dizolvarea se
pot produce și alte procese Ce
anume se stabilesc interacției
cu formare de legături între particulele
de spălat și de solvenți aceste
intenții dintre particulele de
soluții solvenți pot duce la următoarele
la disocierea în Ion sau la ionizarea
substanțelor ionice și a substanțelor
polar sau mai pot duce la salvatoarea
moleculelor sau ai anilor dizolvați
cu molecule de solvenți când solventul
este apa procesul se numește hidratare
Călina solvatare ar trebui să ne
imaginăm o moleculă de solut înconjurată
de mai multe molecule de solde
Haideți să vedem Ce procese au
loc la dizolvarea compușilor ionici
în apă la dizolvarea compușilor
ionici au loc interactii între
ionii de cristal la a compusului
și moleculele de apă moleculele
de apă din păstrează între Jean
și distruga structura unui compus
ionic Sorin compuși ionici dacă
vă mai amintiți au acele structuri
cristaline ordonate dacă am putea
să ne uităm la o soluție apoasă
de sare adică de clorură de sodiu
a vedea că la nivel molecular lucrurile
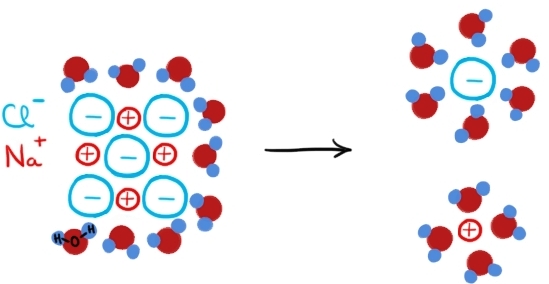
stau ca am în această imagine acestea
sunt moleculele de apă iar Aceștia
sunt Ioni de sodiu și clor mini
sarcinile parțial pozitive ale
atomilor de hidrogen din moleculele
de apă pot simula o sarcină pozitivă
reală cu Mircea ionului de sodiu
plus și pot face asta mai ales
când sunt prezente mai multe molecule
de apă cu mai multe sarcini parțiale
pozitive astfel ionul clor minus
este ademenit de moleculele de
apă își părăsește Ion de sodiu
plus la fel sarcinile parțial negative
ale atomilor de oxigen de la mai
multe molecule de apă pot simula
sarcina negativă reală a ionului
de clor minus a devenind ionul
de sodiu să își părăsească vecinul
claw astfel ionii de clor și de
sodiu se lasă păcălit de moleculele
de apă a fiind despărțit și împrăștiați
printre moleculele de apă din soluție
fiecare Ion din cristalul de sare
este înconjurat în acest fel de
mai multe dipoli de apă cu care
Stabilește interacției Ion Depot
interacție Ion dipoli este mult
mai slabă decât Forțele de atracție
electrostatice dintre ionii care
asigură structura rigida cristalului
John însă mai multe interactii
slabim jumate ajuns să depășească
forța de atracție electrostatică
dintre Ion asta după principiul
london's doi puterea crește și
astfel ionii se desprind de cristal
trecând în soluție înconjurați
de molecule de apă adică hidrata
Așadar în cazul substanțelor ionice
odată cu fenomenul fizic de dizolvare
în solvenți cum este apa Audi și
procese de disociere a substanței
respective în Ion și mai au loc
și procese de solvatare ionilor
cu moleculele de solvent sau de
hidratare în cazul apei reci aceeași
Ioni înconjurați de moleculele
de apă sunt Ion hidratat dar nu
tot Ioni pot fi păcălit de apă
în acest fel Uniunii compuși ionici
atracție electrostatică dintre
Ion este atât de puternică încât
nu poate fi simulată mici de foarte
foarte multe molecule de apă care
stinge acolo în jurul ionilor Ionel
respectiv rămând fideli unul altuia
iar substanța este insolubil este
cazul clorurii de argint solidar
insolubil dar și a multor altor
compuși este motivul pentru care
relieful planetei supraviețuiește
tocmai pentru că apa nu poate din
barăcile decât prin eroziune lor
de a lungul miilor de ani dar pentru
că nu toți compușii sunt eu nici
Haide să vedem și care sunt procesele
care au loc la dizolvarea în apă
a substanțelor cu molecule polare
în cazul dizolvării în apă a compușilor
molecular se formează legături
de polipol între dipoli apei și
molecule nepolare de soluții de
data aceasta a legăturile care
se formează sunt oltean întrucât
atâta Apa este o moleculă polară
ce are dipoli cât și moleculele
care se dizolvă sub acțiunea acestor
forțe intermoleculare dipoli de
slaba dar numeroase molecula polară
disolut trece în soluție ca în
moleculă hidratată în majoritatea
cazurilor după procesul fizic de
dizolvare a moleculelor polare
pot avea loc interacțiuni de natură
fizică prin intermediul forțelor
Vanderbilt adică di polipol sau
pot avea loc iar interacțiuni de
natură ca atunci când se stabilesc
noi legături covalente se formează
în soluție noi specii chimice diferite
de cele care intră în alcătuirea
inițială a solului Spre exemplu
în cazul obținerii unei soluții
apoase de acid clorhidric dizolvarea
ca proces fizic constituie numai
o primă etapă a procesului de dizolvare
care este mult mai complex aceasta
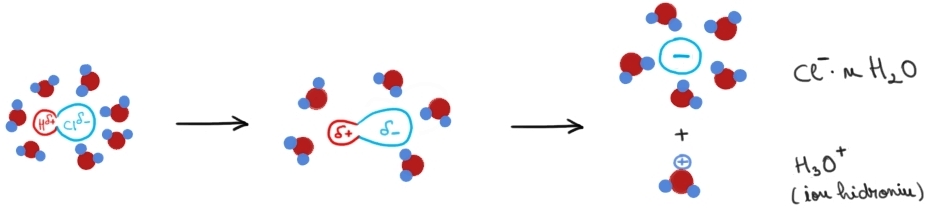
este molecula de acid clorhidric
Care este înconjurată de molecule
de apă ce formează interacțiunile
dispozitivul între sarcina parțial
pozitivă a hidrogenului din molecula
de acid clorhidric si între sarcinile
parțiale negative ale atomilor
de oxigen din moleculele de apă
la fel se formează interacțiuni
Depot Depot între sarcină parțial
negativă a clorului din molecula
de acid clorhidric sidra sarcinile
parțial pozitive ale atomilor de
hidrogen din moleculele de apă
în etapa următoare au loc procese
chimice se rupe legătura covalentă
polară dintre clor și hidrogen
sub acțiunea forțelor de atracție
datorată interactii lordi polipol
după aceasta are loc formarea ionilor
hidrata alții de clor Adică ai
unor clorură înconjurat de un număr
n de molecule de apă și mai are
loc și formarea ionului hidroniu
acesta este Deci un Ion hidroniu
molecula de apă este o moleculă
neutră per total Deci când ionul
hidrogen plus intră în componența
molecule ca urmare a procesului
de dizolvare aduce cu sine și sarcină
pozitivă care va fi preluat de
întreaga moleculă să vedem Și ce
se întâmplă în cazul moleculelor
organice molecule formate predominant
din atomi de carbon și hidrogen
multe dintre aceștia se dizolvă
în apă veniți vă las zahăr iar
multe nu se dizolvă în apă Cum
este uleiul Spre exemplu în mare
măsură diferența aceasta e datorată
componenței moleculelor organice
dacă În compoziția lor aceste molecule
au și alții atom pe lângă cei de
carbon și hidrogen atunci vor avea
și sarcini parțiale pe care apa
le poate imita și Deci va putea
păcăli molecula asa se Diesel de
exemplu aceasta este formula chimică
a zahărului Deci vedem că în componența
acestei molecule pe lângă atomii
de carbon și hidrogen avem și atomi
de oxigen Pe de altă parte sunt
hidrocarburile substanțele uleioase
care sunt formate numai atom de
carbon și hidrogen acestea nu se
dizolvă în apă între carbon și
hidrogen nu e o diferență foarte
mare de electronegativitate ceas
fălcile parțiale din moleculă sunt
atât de slab încât apa nu le poate
imita Deci substanțele aceste ani
nu se vor dizolva în apă așadar
am înțeles în această lecție Ce
presupune dizolvarea substanțelor
cu structuri diferite dar pentru
chimiști Este de ajuns să dizolve
niște cristale întru solvent a
trebuie să știe exact cantitatea
de soluție o soluție și mai ales
trebuie să cunoască concentrațiile
tuturor soluțiilor pentru a putea
efectua experimente chimice Deci
data viitoare vom vorbi despre
concentrațiile soluțiilor