Sulfatul de potasiu, K2SO4, este o pudră albă, cristalină, solubilă în apă și insolubilă în etanol. Are punctul de topire la 1069°C. Sulfatul de potasiu cristalizează în sistemul rombic, iar peste 587°C în sistemul hexagonal.
Sulfatul de potasiu se întâlnește în natură sub formă de picromerit, K2Mg(SO4)2(H2O)6, și în lacuri sărate de unde este separat prin cristalizare fracționată. De asemenea, sulfatul de potasiu se mai poate produce și prin procesul Hargreaves, care presupune oxidarea clorurii de potasiu cu acid sulfuric. În laborator poate fi produs prin reacția acidului sulfuric fie cu hidroxid de potasiu, fie cu carbonat de potasiu.
Sulfatul de potasiu, K2SO4, se prepară din sulfat de magneziu și clorură de potasiu:
MgSO4 + 2KCl 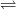 K2SO4 + MgCl2
K2SO4 + MgCl2
Sulfatul de potasiu formează cu sulfatul de magneziu o sare dublă, K2SO4·MgSO4·6H2O, greu solubilă, care, după filtrare, se tratează din nou cu clorură de potasiu:
K2SO4·MgSO4·6H2O + 2KCl = 2K2SO4 + MgCl2 + 6H2O
Sulfatul de potasiu este o substanță albă, cristalină (cristalizează în sistemul rombic, iar peste 587°C în sistemul hexagonal). Sulfatul de potasiu se folosește mai ales în cimenturi, în industria sticlei, dar și ca aditiv alimentar și ca îngrășământ (sursă de ioni K+) pentru plantele sensibile la cloruri, precum tutunul și citricele.
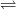 K2SO4 + MgCl2
K2SO4 + MgCl2





