Sulful, S, este un nemetal galben din grupa 16 (VI A) cu număr atomic 32 și masă atomică 32,064. Sulful există în natură sub formă de sulfiți și sulfați, dar există și zăcăminte de sulf nativ; are mai multe forme alotropice. Sulful este un element esențial pentru organismele vii - face parte din aminoacizii cisteină și metionină, deci intră în componența multor proteine. De asemenea, este un element constituent al unor metaboliți celulari, de exemplu, coenzima A.
În natură, sulful se găsește atât în stare nativă, cât și sub formă de compuși.
Nativ, există în Italia (Sicilia), în SUA (în Luisiana și Texas), în Japonia, în Caucaz, în Crimea. Și în România s-au descoperit unele zăcăminte de sulf nativ.
Dintre compușii sulfului, foarte răspândiți în natură sunt sulfurile, și anume:
-
pirita (sulfură de fier, FeS2);
-
calcopirita (sulfură de fier și cupru, CuFeS2);
-
galena (sulfură de plumb, PbS);
-
blenda (sulfură de zinc, ZnS).
Și sulfații precum:
-
ghipsul (sulfat de calciu, CaSO4 ・ 2H2O)
-
baritina (sulfat de bariu, BaSO4), etc.
În gazele vulcanice, sulful se găsește sub formă de hidrogen sulfurat și dioxid de sulf.
Litosfera conține circa 0,03% sulf. În apa mărilor se găsește sulf în proporție de 0,09%. Se crede că în scoarța pământului, sub învelișul de silicați există o zonă formată din sulfuri.
Sulful există și în unele substanțe organice: țiței, cărbuni, plante și chiar animale. Este un element constitutiv al organismului; astfel, unele proteine conțin 0,8 - 2,4% S legat chimic. Mirosul pătrunzător al unor plante, cum sunt ceapa, usturoiul și muștarul, se datorează de asemenea unor combinații cu sulf (mercaptani și sulfuri) rezultate din proteine.
Prin acțiunea apei și a bioxidului de carbon asupra sulfurilor aflate aproape de suprafața pământului rezultă hidrogen sulfurat:
CaS + CO2 + H2O → CaCO3 + H2S
Hidrogenul sulfurat este imediat oxidat în aer la sulf (procesul are loc sub acțiunea unor bacterii speciale, bacterii sulfuroase):
2H2S + O2 → 2H2O + 2S
O parte din sulful rezultat poate forma zăcăminte; altă parte, în exces de aer, suferă o oxidare până la acid sulfuric:
2S + 3O2 + 2H2O → 2H2SO4
Iar acidul sulfuric, la rândul lui, reacționează cu diferitele săruri din sol sau din apă formând sulfați:
H2SO4 + CaCO3 → CaSO4 + H2O + CO2
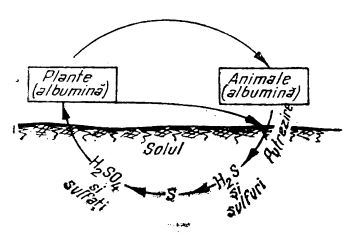
În felul acesta rezultă depozitele de sulfați din natură. O parte din acești sulfați pot fi reduși la sulfuri, care, la rândul lor, pot trece în hidrogen sulfurat. Acesta fie se degajă în stare gazoasă, fie se dizolvă în apele subterane, care ajung la suprafață sub formă de izvoare sulfuroase. O altă parte din sulfații din pământ este extrasă de către plante prin rădăcini - pentru a se transforma în corpul lor, prin procese biochimice, în proteine. Animalele, hrănindu-se cu plante, introduc sulful în corpul lor. După moarte, corpul animalelor putrezind, proteinele se descompun și sulful se elimină sub formă de hidrogen sulfurat și reintră în circuit (după cum e ilustrat în figura de mai jos).
Circuitul sulfului în natură
Sulful se poate obține fie prin extracție din zăcăminte, fie prin separare din compuși.
se bazează pe proprietatea sulfului de a avea un punct de topire relativ scăzut față de celelalte substanțe de care este însoțit în minereuri.
Obținerea sulfului din minereuri native se face în cuptoare de diferite construcții. Cele mai simple sunt formate dintr-o vatră înclinată pe care se așază bulgări de minereu de sulf. Totul se acoperă cu ghips și se dă foc. Căldura degajată prin arderea unei părți din sulf topește restul de sulf, care, topit, se scurge pe vatră, de unde este colectat. Aceasta este cea mai veche metodă de obținere a sulfului; ea mai este aplicată în Sicilia (procedeul calcheronilor).
În procedeele mai perfecționate se folosesc cuptoare cu mai multe camere, unite între ele cu canale, prin care circulă gazele de ardere și aerul. Avantajul acestor cuptoare constă într-o mai bună utilizare a căldurii degajate prin arderea parțială a sulfului (gazele calde provenite de la topirea minereului, înainte de a fi evacuate, încălzesc minereul proaspăt care urmează să fie topit).
În Japonia topirea minereului de sulf nativ se face cu ajutorul aburului supraîncălzit, în autoclave.
În țările unde sulful nativ se găsește la adâncimi mari, se aplică metoda de extracție cu vapori de apă, direct din zăcământ (procedeul Frasch). Pentru aceasta se introduc în pământ sonde formate din trei țevi concentrice de fontă, până ce întâlnesc zăcământul de sulf (după cum e ilustrat în figura de mai jos). Prin țeava exterioară se injectează abur supraîncălzit (160-170°C), sub presiune, care topește o parte din sulful din zăcământ. Acesta se adună în partea inferioară a sondei. Prin țeava centrală se introduce aer sub presiune; amestecul de aer și sulf topit se ridică la suprafață prin a doua țeavă concentrică. Prin acest procedeu se obține un sulf de puritate 99,6% S, care nu mai trebuie rafinat.
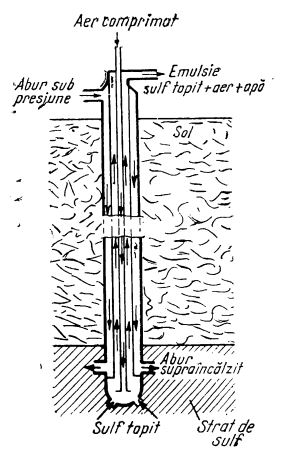 Extragerea sulfului cu abur prin metoda Frasch
Extragerea sulfului cu abur prin metoda Frasch
2FeS2 → 2FeS + 2S
Căldura necesară este dată prin arderea FeS până la Fe2S3 și SO2.
Sulful se poate obține și din calcopirită, prin topire reducătoare, odată cu mata de cupru.
O valoroasă sursă de sulf pentru unele țări o constituie gazele de la cocserie, care conțin sulf sub formă de hidrogen sulfurat. Din aceste gaze se pot recupera 2-5 kg sulf/t de cocs.
Sulful brut este de cele mai multe ori supus unei rafinări în cuptoare speciale, încălzite cu gaze industriale, la o temperatură de peste 450°C (adică mai mare decât temperatura de fierbere a sulfului). Vaporii de sulf rezultați, parțial se lichefiază în bazinul cuptorului, de unde se toarnă în forme (bastoane sau blocuri), parțial sublimează pe pereții reci ai unor camere, depunându-se ca o pulbere fină (floare de sulf).
Sulful este o substanță solidă, fărâmicioasă, de culoare galbenă, rău conducătoare de căldură și electricitate. Are un miros caracteristic, deoarece în contact cu aerul umed se formează cantități mici de hidrogen sulfurat și dioxid de sulf.
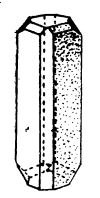
Sulful apare în mai multe stări alotropice. La temperatura obișnuită este stabil sulful cristalizat în sistemul rombic (figura de mai jos), care are densitatea 2,06 (sulful α). Sulful rombic este slab conducător de electricitate și de căldură. Când este frecat se încarcă cu electricitate negativă. Este insolubil în apă, dar se dizolvă bine în sulfură de carbon (la 22°C se pot dizolva 46,1 părți sulf în 100 părți sulfură de carbon); dacă se evaporă dizolvantul (sulfura de carbon), se obține din nou sulful rombic. În mică măsură sulful rombic este solubil și în benzen, alcool și eter.
Sulf rombic
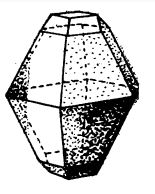
Încălzit la peste 110°C, sulful rombic se topește trecând într-un lichid galben-auriu, foarte fluid. Dacă acest lichid este lăsat să se răcească într-un creuzet și prin stratul solid format la suprafață se scurge sulful rămas încă lichid, se poate observa că pereții creuzetului sunt acoperiți cu cristale aciculare de culoare galbenă-deschisă de sulf cristalizat în sistemul monoclinic (sulful β). Punctul de transformare a sulfului rombic în sulf monoclinic este 95,6°C.
Sulful monoclinic (ilustrat în figura de mai jos) are densitatea de 1.96 și se topește la 119°C, transformându-se într-un lichid galben. Aceasta este adevărata temperatură de topire a sulfului. Sulful monoclinic nu este stabil la temperatura obișnuită; cu timpul se transformă în sulf rombic.
 Sulf monoclinic
Sulf monoclinic
Sulful topit încălzit peste 160°C se închide la culoare și devine mai vâscos, iar pe la 200°C are o consistență rășinoasă. Încălzit peste 250°C, vâscozitatea lui scade din nou, iar la 400°C sulful devine fluid; la 444,6°C fierbe.
Dacă sulful încălzit la temperatura de fierbere este turnat în apă rece, se obține o masă elastică, de culoare brună; acesta este așa numitul sulf plastic. Sulful plastic este numai parțial solubil în sulfura de carbon.
Comportarea deosebită a sulfului plastic se datorează existenței altor două modificații ale sulfului, sulful λ și sulful μ, care sunt în echilibru; primul este de culoare galbenă și este solubil în sulfura de carbon și este mai vâscos.
Dacă sulful plastic este lăsat câteva zile la temperatură obișnuită el se transformă din nou în sulf cristalin rombic.
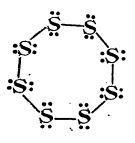
Cercetări efectuate cu raze X au arătat că sulful cristalin are moleculele alcătuite din opt atomi (S8), formând un ciclu, în care fiecare atom de sulf este legat de alți doi atomi de sulf prin câte o legătură covalentă:
Acești opt atomi nu sunt așezați în același plan, ci molecula are forma unei coroane:
Molecula de sulf
Cu creșterea temperaturii are loc o scădere a numărului de atomi de sulf din molecule. Vaporii de sulf sunt alcătuiți din molecule de mărimi diferite: S8, S6, S4, S2; la peste 2000°C moleculele de sulf devin monoatomice. Sulful plastic are moleculele alcătuite dintr-un număr mare de atomi, formînd macromolecule, rezultate prin desfacerea ciclurilor S8 și reunirea lor în lanțuri foarte lungi:
Când sulful plastic se transformă din nou în sulf cristalin, lanțurile de macromolecule se desfac și se formează din nou moleculele ciclice S8.
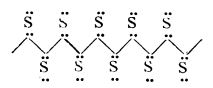
După
Linus Pauling, molecula S
2 ar conține cei doi atomi de sulf uniți printr-o legătură covalentă și două legături trielectronice,

(ca și molecula de oxigen).
Sulful este o substanță reactivă. Se combină cu aproape toate elementele. Astfel, aprins, arde ușor cu flacără albăstruie, formând dioxid de sulf, SO2; încălzit în aer până la 250°C se aprinde de la sine (această temperatură este punctul lui de aprindere). În prezență de catalizator, oxidarea sulfului poate merge până la trioxid de sulf, SO3.
Cu hidrogenul, sulful se combină mai greu; numai la o temperatură mai mare de 300°C se formează hidrogen sulfurat, H2S.
Sulful se combină ușor cu halogenii, cu excepția iodului. La temperatură înaltă se combină cu carbonul, formând sulfura de carbon, CS2.
Sulful se combină și cu metalele formând sulfuri, reacția având loc uneori chiar la temperatura obișnuită. Astfel, dacă se freacă o bucată de argint cu pulbere umedă de sulf, argintul se acoperă cu un strat negru de sulfură de argint, Ag2S. Tot așa, dacă se freacă într-un mojar pulbere de sulf umedă, cu mercur, se obține o pastă neagră de sulfură de mercur, HgS.
Combinarea sulfului cu metalele de fier, cupru, aluminiu, plumb, etc. necesită încălzire până la începerea reacției. Căldura degajată ajută la continuarea acesteia. Se amintește combinarea sulfului cu fierul, când se formează sulfura de fier, FeS.
Dacă se tratează o soluție de polisulfură de calciu (obținută prin fierberea laptelui de var cu sulf) cu acid clorhidric diluat, se obține un lichid cu aspect lăptos, laptele de sulf, format dintr-o suspensie de particule de sulf, fin divizate în apă sau în soluție de clorură de calciu.
Dacă se introduce la rece hidrogen sulfurat într-o soluție concentrată de dioxid de sulf, se obține o soluție coloidală de sulf. Din asemenea soluții, sulful poate fi precipitat cu un adaos de electrolit.
Sulful coloidal este întrebuințat la prepararea unor insecticide agricole cât și în medicină, contra bolilor de piele, de exemplu contra râiei.
În țările unde există mari zăcăminte de sulf, sulful se folosește la prepararea dioxidului de sulf, din care se fabrică apoi acid sulfuric, sulfiți, hiposulfiți, etc.
Împreună cu cărbunele, sulful formează materiile prime pentru fabricarea sulfurii de carbon (un bun dizolvant). De asemenea este folosit la fabricarea coloranților de tipul ultramarinului și a celor derivați din gudroane (coloranți de sulf).
Importantă este întrebuințarea sulfului la vulcanizarea cauciucului și la fabricarea ebonitei (adaosul de sulf le mărește rezistența și elasticitatea).
În industria petrolieră, sulful este folosit la rafinarea benzinei.
Sulful amestecat cu clorat de potasiu și cărbune formează praful de pușcă și alte pulberi pentru focuri de artificii. La fabricarea chibriturilor se folosește uneori sulf în compoziția pastei cu care se îmbibă lemnul.
Foarte cunoscută este utilizarea sulfului pentru combaterea filoxerei viței de vie, precum și ca decolorant (sub formă de dioxid de sulf).
În construcții se folosește sulful ca liant pentru prinderea barelor de oțel în piatră.
Sulful formează un număr mare de combinații în care se manifestă cu diferite numere de oxidare, dintre care cele mai importante sunt următoarele:
Combinațiile sulfului
| Număr de oxidare |
-2 |
0 |
+4 |
+6 |
| Exemple de combinații |
H2S
S2- |
S8 |
SO2
H2SO3
SO32- |
SO3
H2SO4
SO42- |
Sulful formează cu hidrogenul o serie de combinații cu formula generală H
2S
n,
hidrogeni polisulfurați sau
sulfani, dintre care cel mai important este monosulfanul, H
2S, adică
hidrogenul sulfurat.
Sulful formează cu oxigenul următorii oxizi:
De semenea, poate forma și doi peroxizi:
Dintre aceștia, dioxidul de sulf este anhidrida acidului sulfuros, iar trioxidul de sulf este anhidrida acidului sulfuric.
Oxoacizii sulfului și sărurile lor au următoarele formule și denumiri:
(x poate avea valorile 3, 4, 5, 6)
De la heptoxidul de sulf, S2O7, derivă doi peroxoacizi:
Acești peroxoacizi pot fi considerați derivați ai apei oxigenate cu acid sulfuric.


 (ca și molecula de oxigen).
(ca și molecula de oxigen). 





