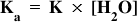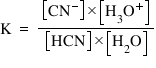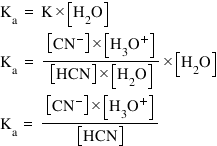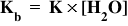Tăria acizilor şi bazelor – amfoliţi acido-bazici
Partajeaza in Google Classroom

Transcript
lecția trecută am văzut că acizii
sunt substanțele care pot dona
protoni iar bazele sunt substanțele
care pot accepta Proto acizii și
bazele se pot clasifica după mai
multe criterii însă cel mai important
criteriu pentru practică este criteriul
tăriei acidobazice conform acestui
criteriu acizii se clasifică în
naci stari și acizi slabi spunem
că un acid este tare dacă disociază
complet în apă adică Dacă toate
moleculele ionizează în soluție
apoasă formând un Ion și un Proton
sau un Ion de hidrogen care se
va legat de o moleculă de apă ducând
la apariția unui Ion hidroniu șasea
Ce sunt considerați ca fiind acesta
Aceștia sunt acidul clorhidric
acidul azotic acidul sulfuric acidul
bromhidric acidul iodhidric și
acidul percloric să luăm exemplul
acidului clorhidric am discutat
iar lecția trecută că o soluție
apoasă de acid clorhidric conține
numai Ion clorură și Ion de hidroniu
faptul că în soluție găsim numai
acești Ion e simbolizat de această
săgeată pe care o folosim la scrierea
reacției Deci nu mai există deloc
molecule de acid clorhidric pentru
că acestea au ionizat complet punând
în libertate Ion de hidroniu în
concentrație egală cu concentrația
acidului introduse inițial în soluție
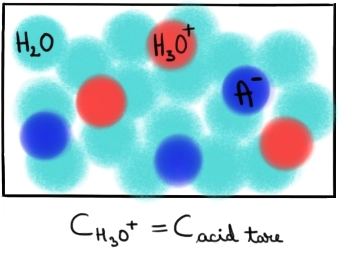
reprezentat schematic în acest
fel ionizare acizilor tari în soluție
apoasă avem Deci un acid tare Hei
tare în soluție disociază anionul
ani nu iar protonul său se leagă
imediat de apă formând hidroniu
celelalte molecule sunt moleculele
de apă din soluție iar concentrația
ionilor hidroniu este egală cu
concentrația acidului tare introdus
în soluție de exemplu dacă dizolvăm
acid azotic 0 Molnar în apă ecuația
reacției este aceasta ei citat
vot plus apă obținem ionul azotat
plus ionul hidroniu iar concentrația
molară de Ion hidroniu este egală
cu concentrația inițială de acid
azotic adică cu 0 moli pe litru
în cazul acizilor tari protonul
este cedat foarte ușor despre ne
gândim la un acid tare știu că
acesta abia așteaptă să scape de
protoni Deci îți dă oricui este
în cale fiecărei vorba de ea sau
de alte substanțe de aceeasi zi
dar sunt atât de periculoși în
schimb acizi slabi sunt ceva mai
atașați de protonilor de aceea
putem mânca liniștiți citrice care
conțin bineînțeles acid citric
A dar să nu vă gândiți că dacă
le achit dar nu e chiar așa periculos
Spre exemplu acidul cianhidric
un acid slab este o treabă puternică
fiind un acid slab acesta ionizează
parțial în soluție apoasă când
scrie ecuația reacției care are
loc la dizolvarea acidului citric
în apă trebuie să arătăm că sunt
două procese care se desfășoară
în sensuri opuse reacția de ionizare
a acidului cianhidric dizolvat
prin care se obține onion cianură
și Ion hidroniu și mai are loc
și reacția inversă de formare a
acidului cianhidric și a apei din
Ion ai aflat soluție practicând
soluție apoasă de acid cianhidric
există atât molecule de acid cianhidric
cât și onion cianură și Ion hidroniu
cele două reacții chimice au loc
în același timp în sensul opus
până când se ajunge la o stare
de echilibru exact așa cum am discutat
în capitolele despre echilibrul
chimic putem reprezenta ionizare
acizilor slavian soluție tot pentru
astfel de schemă de centru o soluție
apoasă de acid slab coexistă molecule
de acid pe care le notăm generic
cu ei de asemenea găsim anioni
A minus și găsim și eu închid RON
și pentru că acizii slabi ionizează
numai parțial înseamnă capul în
libertate o concentrație mai mică
de Ion de hidroniu decât concentrația
acidului introdus în soluție Plasați
zii lor slabi conține un număr
foarte mare de Spre exemplu acidul
fluorhidric acidul carbonic acidul
sulfhidric acidul azotos sau acidul
acetic care se găsește în oțet
și mulți alții acizi deci între
atâția ce slabi Cum ne dăm seama
care este totuși mai tare adică
cum putem compara Tăria acizilor
slab aici intervine Constanța de
aciditate notată cu k indice a
să revenim la dizolvarea acidului
cianhidric în apă aplicăm lege
a acțiunii maselor pe care o știm
de la echilibrul chimic și obținem
Constanta de echilibru ca apa egală
cu produsul dintre concentrația
ionilor cianură și concentrația
ionilor hidroniu supra produsul
dintre concentrația acidului cianhidric
și apei concentrația apei este
practic constantă în soluție apoasă
aproximativ egale cu cea inițială
deoarece doar o mică parte din
acid reacționează cu moleculele
de apă astfel că valoarea constantei
de echilibru înmulțită cu concentrația
apei este egală cu ca ei adică
cu Constanța de aciditate cine
uităm la raportul de mai sus dacă
înmulțim Constanța de echilibru
cu concentrația apei vedem că aceasta
a se simplifică Deci rămânem doar
cu ca a Care este egală cu concentrația
ionilor cianură ori concentrația
ionilor hidroniu supra concentrația
acidului cianhidric Constanța de
aciditate este o mărime care caracterizează
Tăria unui acid cu cât această
constantă e mai mare cu atât acidul
va ceda protoni mai ușor putem
de foarte ușor faptul că un acid
tare ionizează total iar unul slab
ionizează parțial plecăm de la
două soluții de aceeași concentrație
1 molar o soluție va fi de aceeasi
clorhidric 1 molar și cealaltă
soluție va fi de acid slab acid
cianhidric tot 1 molar când trece
curent electric printr o instalație
conectată la un bărbat că la instalația
în care le avem acid clorhidric
1 molar becul se aprinde cu lumină
puternică în cazul soluției de
acid Da pe Cum se aprinde dar intensitatea
luminoasă este mult mai slabă Acest
lucru se întâmplă deoarece în soluția
de acid clorhidric acesta ionizează
aproape complet 99 în timp ce în
soluția de acid cianhidric acte
de este ionizat în proporție de
numai 0 și de aceea nu conduce foarte
bine curentul electric la fel se
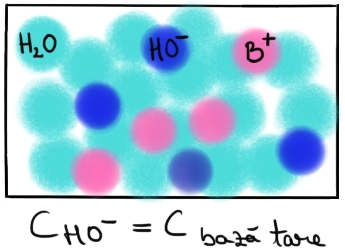
clasifică și bazele avem baze tari
și baze slabe bazele tari acceptă
protoni foarte ușor la fel ca a
soluției de acid clorhidric o soluție
de hidroxid de sodiu conduce foarte
bine curentul electric asta deoarece
și bazele tari disociază completând
soluției apoase astfel încât se
transformă total în cationii tratat
și Union de hidroxi pentru astfel
de soluție concentrația de Ion
este egală cu concentrația bazei
introduse în soluție si aceasta
este schema pentru ionizarea bazelor
tari notate cu formula generală
b u h între o soluție apoasă de
soluție se găsesc cationii b plus
și Ion in hidroxid în care a disociat
bază tare din categoria B lor tari
fac parte hidroxizii metalelor
alcaline și cât var hidroxizi ai
metalelor alcaline o pământ oase
adică hidroxizi elementelor din
grupa întâia și a doua principal
Spre exemplu hidroxidul de litiu
hidroxidul de sodiu hidroxidul
de potasiu sau hidroxidul de bariu
Așadar hidroxidul de sodiu disociază
complet în apă formând cationul
de sodiu și Ionuț hidroxid și reprezentau
acest lucru printre o singură săgeată
mai putem scrie ecuația procesului
de disociere a unei baze tari și
în acest fel hidroxid de sodiu
plus in molecule de apă obținem
catul și tratați cu molecule de
apă și Ionuț hidroxi astfel scoțând
în evidență și moleculele de apă
implicate în proces care hidra
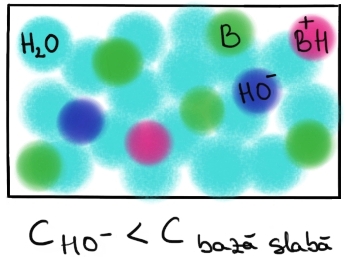
cationul bazele sunt puțin mai
recente le acceptă mai greu protoni
și nu ionizează complet în soluție
apoasă astfel că în soluție apoasă
de bază silabe cu există molecule
de bază cu cationii și cu Ione
hidroxil în care au disociată unele
molecule concentrația de Ion hidroxil
este Deci mai mică decât concentrația
de bază slabă care a fost introdusă
în soluție ce avem aici și schemă
în care e reprezentată ionizarea
bazelor slabe soluție de data aceasta
notăm bază slabă cu formula generală
b trebuie c există și bazei care
chiar dacă nu sunt hidroxi Deci
nu pute liberă Ion hidroxid prin
disociere reacționează în schimb
cu apa din soluție formând Ioan
hidroxi un exemplu este chiar amoniac
unde reacția dintre amoniac și
apă un Proton al apei este atras
de perechea de electroni neparticipanți
a atomului de azot discutat despre
asta mai pe larg în lecția despre
legătura coordinativă astfel se
formează ionul amoniu și Ion hidroxid
de ce moleculă de apă și o molecule
de amoniac formează ionul amoniu
și Ionuț hidroxi observăm că și
în acest caz la fel ca în cazul
acizilor slabi în același timp
cu reacția de formare a ionului
amoniu are loc și reacția opusă
de formare a amoniacului Aplicând
legea acțiunii maselor obținem
Constanța de echilibru a ecuației
Care este egală cu produsul dintre
concentrația ionilor amoniu și
a ionilor hidroxid supra produsul
dintre concentrația Moni cu lui
și ea la fel ca în cazul Constantin
de aciditate obținem Constanta
de bazicitate pe care o notăm cu
k indice b înmulțim Constanța de
echilibru cu concentrația apei
Deci Constanta de bazicitate este
egală cu produsul dintre concentrația
ionilor amoniu și concentrația
ionilor hidroxid supra concentrația
amoniacului Constanța de bazicitate
a fiind mărimea care caracterizează
Tăria unei baze cu cât costă de
bazicitate este mai mare cu atât
și baza ei este mai tare adică
acceptă protoni mai ușor pe lângă
amoniac alte exemple de baze slabe
sunt hidrazina sau anionii acizilor
slabi precum Ionuț cianură sau
ai unor carbonat Bun deci pare
totul foarte clar în privința acizilor
și a bazelor dacă îi donează protonii
este acid dacă numește Proton este
basm Dar pentru că întotdeauna
există un dar lucrurile nu sunt
chiar atât de stil există substanțe
care respectând teoria protolitica
se comportă fiecare caz a Totul
depinde de mediul de reacții în
care se află câte ceva numai cum
ne comportăm ca elevi Când este
un profesor în clasă și cum ne
comportăm Când este nicio profesor
în preajmă e o diferență destul
de mare nu e așa la fel există
multe substanțe care reacționează
atât cu acizi Deci au Caracter
de bază dar aceleași substanțe
reacționează și cu baze Deci au
Caracter de acid aceste substanțe
au caracter amfoter Deci spunem
că sunt amfolitii acidobazice Apa
este cel mai bun exemplu de amfolit
acidobazic o moleculă de apă poate
ceda un Proton fiind Deci Unison
molecula de apă poate și Să accepte
un Proton prin Deci o bază aceste
două reacții au loc aproape în
același timp deoarece protonul
nu poate exista în stare liberă
în soluție reacția globală de ionizare
a apei fiind aceasta două molecule
de apă ionizează în ionul hidroniu
și ionul hidroxid de aici din cele
două molecule de apă una ionizează
iar cealaltă accepta protonul format
în urma ionizării după cum am arătat
în aceste de o reacție dintre un
volum de apă numai un număr foarte
mic de molecule din viață asta
înseamnă că apa conduce electricitatea
dar de mii de ori mai puțin față
de soluția de acid clorhidric exemplu
Care este ionizată complex caracterul
amfoter al este motivul pentru
care apa acționează ca cel mai
bun solvent atât pentru A5 cât
și pentru baze când un acid se
dizolvă în apă Ia poate acționa
ca bază iar când o bază se dizolvă
în apă ea poate acționa caci mai
stea poliția Sido bazici sunt hidroxi
ai unor metale de exemplu hidroxidul
de aluminiu sau hidroxidul de zi
așa dar am văzut lecția aceasta
că unii acizi abia așteaptă să
scape de un Proton iar alții A5
renunță mai greu la protos cea
mai văzut și că unele bazei așteaptă
protonii cu brațele deschise dar
sunt și alte baze care primesc
protoni în mai greu data viitoare
vom vedea De ce este atât de important
să știm ce se întâmplă cu protoni
sau cu Ioni de hidrogen dintre
o soluție Deci vom vorbi despre
ph soluțiilor

 NO3- + H3O+
NO3- + H3O+