Titanul, Ti, este un metal de tranziție alb din grupa 4 a tabelului periodic (grupa a IV-a secundară sau grupa IV B); are numărul atomic 22 și masa atomică 47,9. Punctul de topire al titanului este 1660±10°C, iar punctul de fierbere este 3287°C. Sursele principale de titan sunt mineralele rutil și ilmenit.
Titaniul se găsește relativ abundent în scoarța pământului (0,6%), dar în concentrații mici (este un metal rar). El este răspândit în mineralele rutil (dioxid de titan, TiO2), perowskit, (titanat de calciu CaTiO3), sfen (silicat de calciu și oxid de titan, CaTiO[SiO4]), ilmenit (titanat de fier, FeTiO3). În cantități mai mici se găsește și în alte minerale, de exemplu în amestec cu pământuri rare.
Titanul ca metal se obține prin metode speciale ca, de exemplu, prin tratarea ilmenitului sau rutilului cu cărbune și clor la temperatură ridicată, când rezultă
tetraclorura de titan, TiCl
4, care este redusă cu magneziu topit, la 800°C, în atmosferă de argon. Titanul metalic obținut se prezintă ca o masă spongioasă din care excesul de magneziu și clorura de magneziu sunt îndepărtate prin volatilizare la circa 1000°C. Metalul spongios este apoi topit și turnat în lingouri.
Pentru prepararea titanului de înaltă puritate se folosește metoda descompunerii termice a tetraiodurii de titan în vid, pe un filament incandescent (metoda van Arkel și de Boer):
TiI4 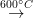 Ti + 2I2
Ti + 2I2
Pentru scopuri industriale se prepară de obicei ferotitanul, un aliaj de fier cu 10-25% titan, care se topește la 1400°C. El se obține prin prelucrarea rutilului cu cărbune în prezență de fier (în loc de cărbune se poate folosi și aluminiu ca reducător).
Titanul este un metal cristalizat în rețea hexagonală compactă. El se aseamănă cu alte metale de tranziție, ca de exemplu cu fierul sau nichelul. Este dur și casant. În stare foarte pură este maleabil.
În formă de pulbere fină, titanul poate absorbi mari cantități de hidrogen (la 20°C, 1 g titan poate absorbi 407 ml hidrogen).
La temperatură obișnuită titanul este stabil la aer; încălzit la roșu arde în curent de oxigen cu dezvoltare de căldură formând dioxid de titan, TiO2. De asemenea se combină cu carbonul la temperatură ridicată și formează carbura de titan, TiC, iar cu siliciul, siliciuri de titan, Ti2Si și TiSi2. Nitrura, TiN, carbura, TiC, și borurile, TiB și TiB2, sunt compuși de interstiție, foarte stabili și duri. Peste 150°C reacționează cu fluorul, iar peste 300°C cu clorul; rezultă halogenurile respective.
Titanul se aliază cu fierul la temperaturi înalte; aliajul obținut este o combinație chimică, Fe3Ti.
Acizii atacă greu titanul, cu excepția acidului fluorhidric; la încălzire formează însă cu acidul clorhidric diluat triclorura de titan, TiCl3. Acidul azotic fierbinte transformă titanul în oxid hidratat, greu solubil în acizi și baze.
Titanul are importanță deosebită în tehnică. Sub forma aliajului ferotitan se folosește ca adaos la oțeluri speciale pentru a le mări rezistența și elasticitatea. Un conținut până la 0,1% titan în oțel împiedică separarea azotului și oxigenului la răcirea oțelului, care altfel ar cauza formarea unui oțel buretos. Sub forma aliajului său cu aluminiu se folosește ca adaos la cupru și la aliajele sale, având rol de dezoxidant.
Aliajele titanului fiind mai stabile la coroziune și mai ușoare decât oțelurile, pot fi folosite în industria chimică, în motoare cu reacție și în construcția de mijloace de locomoție (caroserii de mașini, avioane, elicoptere, vapoare, etc).
Titanul metalic poros este un catalizator activ în unele reacții ale azotului cu hidrogenul sau cu oxigenul.
Titanul în combinațiile sale poate manifesta diferite numere de oxidare, starea cea mai stabilă și mai obișnuită fiind Ti(IV); în toate celelalte stări de oxidare elementul poate fi oxidat de către aer, apă, sau alți reactivi la Ti(IV).
Energia de îndepărtare a celor patru electroni (3d24s2) este așa de mare încât ionul Ti4+ nu are existență reală; compușii de Ti(IV) sunt în general de natură covalentă. În această stare, titanul se aseamănă cu elementele din grupa a IV-a principală, în special cu staniul. Astfel, TiCl4 se aseamănă cu SnCl4, lichide puternic hidrolizabile, fumigene, cu comportări de acizi Lewis.
Sărurile de titan se utilizează pentru impermeabilizări de stofe, în vopsitoria textilă și pielărie. Carbura de titan este folosită ca adaos la unele oțeluri speciale rapide, cărora le conferă duritate (aliaje rapide).
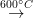 Ti + 2I2
Ti + 2I2





