Trioxidul de sulf sau oxidul de sulf (VI), SO3, este un oxid al sulfului în care atomul de sulf are numărul de oxidare +6. Este un compus solid (uneori lichid, incolor) toxic și iritant ce are trei forme cristaline. În ordinea descrescătoare a stabilității, acestea sunt: 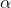 ,
, 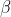 , și
, și 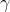 . Trioxidul reacționează violent cu apa cu formare de acid sulfuric; este un intermediar important în prepararea acidului sulfuric și a acidului sulfuric fumans (oleum).
. Trioxidul reacționează violent cu apa cu formare de acid sulfuric; este un intermediar important în prepararea acidului sulfuric și a acidului sulfuric fumans (oleum).
Trioxidul de sulf se prepară prin oxidarea dioxidului de sulf de către oxigen:
2SO2 + O2  2SO3;
2SO3;  H = -23,2 kcal/mol
H = -23,2 kcal/mol
Cum această reacție are loc la temperatură înaltă și este reversibilă, pentru realizarea unui randament cât mai bun este necesară folosirea catalizatorilor.
În laborator, trioxidul de sulf se obține trecând un amestec de dioxid de sulf și oxigen printr-un tub de sticlă, în care se găsește azbest platinat încălzit la 450°C (după cum e ilustrat în figura de mai jos). Amestecul gazos care iese din tub este colectat într-un vas; acesta se umple cu o ceață albă și grea, formată din picături foarte fine de acid sulfuric, provenit din reacția trioxidului de sulf cu vaporii de apă din atmosferă. Când vasul este puternic răcit, se formează o masă albă, cu aspect de gheață, care fumegă la aer.
Prepararea trioxidului de sulf în laborator
Trioxidul de sulf, în stare pură, se obține prin încălzirea acidului sulfuric fumans, adică a acidului sulfuric care conține dizolvat trioxid de sulf în exces.
La temperatură obișnuită, trioxidul de sulf este un lichid incolor care fierbe la 44,8°C. La 16,8°C se solidifică formând o masă albă cristalină (trioxidul de sulf γ). Păstrat la temperaturi sub 25°C, trioxidul de sulf se transformă într-o modificație cu aspect fibros mătăsos (trioxidul de sulf β), care are un punct de topire mai înalt decât trioxidul de sulf γ. Există și o a treia modificație alotropică (trioxidul de sulf α), care se obține în condiții speciale.
Existența acestor diferite modificări alotropice și transformările lor reciproce sunt explicate prin prezența diferitelor specii de molecule polimere (SO3)n.
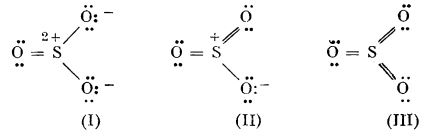
În stare de vapori, trioxidul de sulf este monomer, fiecare moleculă având o structură plană de triunghi echilateral cu atomul de sulf în centru; legăturile S — O sunt echivalente, având distanța de 1,43 Å. Se atribuie moleculei de SO3 o structură intermediară (de rezonanță) între structurile:
Structurile (I) și (II) au la rândul lor structură intermediară între legăturile simple și duble. Spre deosebire de structura (I) la care legăturile sunt formate prin participarea orbitalilor 3s și 3p, la structurile (II) și (III), la formarea legăturilor participă și orbitali 3d ai atomului de sulf.
În stare lichidă se stabilește un echilibru între monomer și un trimer. În stare solidă, forma γ este alcătuită din grupe moleculare trimere:
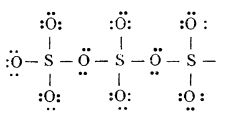
iar forma β, din grupe SO3 individuale legate între ele în lanțuri:
Forma α se aseamănă cu forma β, numai că lanțurile sunt legate între ele formând un plan.
Trioxidul de sulf reacționează energic cu apa, cu dezvoltare de căldură:
SO3 + H2O → H2SO4;  H = -21,28 kcal/mol
H = -21,28 kcal/mol
Din cauza marii afinități a trioxidului de sulf pentru apă, el scoate apa din diferiți compuși, mai ales organici, chiar dacă aceasta intră în compoziția compușilor respectivi.
Cu acidul sulfuric, trioxidul de sulf formează acidul sulfuric fumans sau oleumul. Acesta este constituit mai ales din acid pirosulfuric:
SO3 + H2SO4  H2S2O7
H2S2O7
Trioxidul de sulf este folosit în industria materiilor colorante și la prepararea acidului sulfuric. El servește și ca agent fumigen pentru camuflaje.
,
, și
. Trioxidul reacționează violent cu apa cu formare de acid sulfuric; este un intermediar important în prepararea acidului sulfuric și a acidului sulfuric fumans (oleum).
 2SO3;
2SO3;  H = -23,2 kcal/mol
H = -23,2 kcal/mol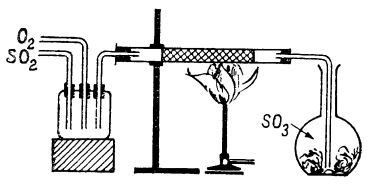
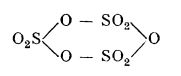
 H = -21,28 kcal/mol
H = -21,28 kcal/mol H2S2O7
H2S2O7





