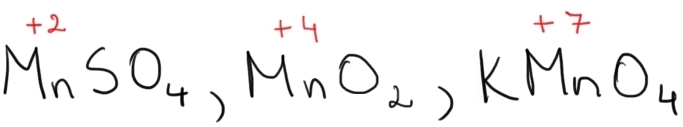Valenţa şi numărul de oxidare - partea II
Partajeaza in Google Classroom

Transcript
am văzut lecția trecută că numărul
de oxidare al unui element este
o noțiune mai generală prin care
putem defini valența astfel încât
să cuprindă atât Electro valențele
ionilor care formează compuși ionici
cât și covalentă atomilor care
formează compușii molecular practic
numărul de oxidare este o sarcină
teoretică sarcina atribuită a atomilor
după anumite reguli despre care
am vorbit data trecută numărul
de oxidare se mai poate determina
și în funcție de electronegativitate
regula pentru efectuarea acestui
calcul este următoarea numărul
electronilor de valență ai atomului
în stare liberă minus numărul electronilor
de valență care sunt Mai puternica
tragi de atomi în moleculă sau
în ionul Pony cea mai zici Ne putem
gândim Cum a făcut mai devreme
acele exercițiu de imaginație că
ar fi numărul electronilor de valență
pe care ar avea un atom dacă ar
face parte dintre un compus ionic
să vedem prin câteva exemple Cum
se determină numărul de oxidare
în funcție de electronegativitate
în cazul molecule de clor știind
că atomul de clor are în stare
liberă șapte electroni pe ultimul
strat în molecula de clor dubletul
electronic de legătură este împărțită
egal între cei doi atomi de clor
pentru că prind atomi identici
iau aceeași electronegativitate
așa că numărul de oxidare al atomilor
de clorul vom calcula astfel 7
numărul electronilor de valență
ai atomului stare liberă minus
7 care în această în moleculă nepolară
formată din atomi identici este
numărul electronilor de valență
care sunt atrași de atomi în molecula
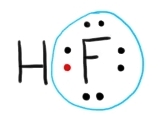
de clor în cazul acidului clorhidric
atomul deflorare în stare liberă
șapte electroni pe ultimul strat
iar în molecula de acid clorhidric
dubletul electronic de legătură
se deplasează mai mult spre flori
pentru că ele are o electronegativitate
mai mare astfel e la Trage mai
puternic opt electroni Deci numărul
de oxidare al clorului va fi în
7 minus 8 Adică minus unu în molecula
de acid clorhidric dubletul electronii
de legătură la care hidrogenul
contribuie cu un electron este
atrasă mai puternic de flori deci
practic hidrogenul atragere puternic
0 electroni așa că numărul său
de oxidare va fi unul minus zero
adică plus unu în cazul diferit
de oxigen dacă nu va convins mai
devreme că oxigenul are numărul
de oxidare 32 îl vom calcula cu
știind că oxigenul are 6 electroni
de valență în stare liberă și minus
4 electroni și numărul de oxidare
Lujerului va fi plus doi Dar de
ce minus 4 electroni e bine Acesta
este numărul de electroni care
au rămas mai fideli nucleului de
oxigen după ce ceilalți doi electroni
pe care îi am reprezentat cu roșu
sunt mai puternic atrași de cei
doi atomi de Flor Deci dacă am
calcula numărul de oxidare al unui
atom de flori din această moleculă
ar fi exact ca în molecula de acid
clorhidric știind că atomul de
florare electronegativitate mai
mare decât a oxigenului astfel
numărul de oxidare al clorului
ca și în cazul acestui fior heydrich
va fi minus unu pentru că fiecare
atom de flori a trage mai puternic
către el dubletul de legătură luând
câte un electron de la Oxigen această
metodă de determinare a numerelor
de oxidare ale elementelor cu ajutorul
electronegativitatii lor cât și
regulile de calcul prezentate în
lecția trecută pot contribui la
o mai bună înțelegere a felului
în care elementele chimice reacționează
totuși ne va fi de folos să înțelegem
și care este corelația între numerele
de oxidare și grupa din tabelul
periodic în care se află atomii
elementelor depinzând de numărul
de electroni de valență elementele
își aleg Calea prin care se realizează
să începem cu elementele din grupele
principale adică aceste două grupe
și aceste șase grupe să ne reamintim
că în cazul acestor grupei principale
numărul electronilor de valență
corespunde cu numărul grupei la
primele două grupe principale iar
la următoarele șase cu numărul
grupei minus 10 Deci în grupa 1
elementele au câte un electroni
de valență în grupa a doua elementele
au câte două electroni de valență
elementele din grupa 13 au câte
trei electroni de valență și tot
așa către patru cinci șase șapte
electroni de valență și întru un
final gazele nobile cu 8 electroni
de valență un elementele care au
mai puțin de 4 electroni de valență
pe ultimul strat adică elementele
din primele trei grupe principale
pot ajunge mai ușor la configurația
stabilă de unde acești electroni
astfel aceste elemente se vor transforma
în John puzzle exemplu magneziu
din grupa a doua magneziului in
voi reprezenta electronii de valență
cu două puncte Deci magneziul va
ceda cinci doi electroni fără să
facă prea multe sigur și se va
transforma în ionul pozitiv magneziu
2 plus Așadar în cazul elementelor
care pot forma Ion pozitiv numărul
de oxidare este egal cu electrovalenta
elemente așa cum și numărul de
oxidare ale sodiului din clorura
de sodiu este egal cu sarcina ionului
din acest compus adică plus unu
sau cum în cazul calciului din
oxidul de calciu numărul de oxidare
va fi egal cu plus 2 care este
și electrovalenta ionului de calciu
în cazul elementelor ale căror
atomi au mai mult de patru electroni
de valență pe ultimul strat de
cele mint din grupele 15 16 și
17 gazele nobile nu are rost să
le luăm considerare ei nu vor nici
să dea niște primească electroni
pentru că sunt perfect mulțumite
cu oțet în schimb în cazul elementelor
din aceste trei grupe ar fi nevoie
de o energie de ionizare foarte
mare pentru a ceda toți electronii
de valență de aceea a nu formează
Ion pozitiv pentru aceste elemente
e mai ieftin din punct de vedere
energetic să primească electroni
pentru a ajunge la configurația
de octet și să vedem și cum ne
dăm seama de Câți electroni are
nevoie un atom pentru a ajunge
la configurația de octet simplu
știind că vrea să aibă opt electroni
pe ultimul strat Dar el are numai
cinci șase sau șapte electroni
de valență Deci facem diferența
dintre o și numărul electronilor
de valență Spre exemplu clorurare
șapte electroni de valență De ce
el mai trebuie doar să accepte
un Electro Deci clor plus un electron
obținem ionul clor minus care are
octeți pe ultimul strat sau ce
genul care are 6 electroni de valență
8 minus șase egal cu doi Deci oxigenul
va primii doi electroni pentru
a ajunge la configurația de octet
pe ultimul strat de cea când electroni
elementele se transformă în Ioni
negativ lucrurile sunt foarte clare
în cazul primelor trei grupe principale
și în cazul grupelor 15 16 și 7
scade apartel reprezintă elementele
grupei 14 care au în stratul de
valență ns2 nt24 electroni el fiind
numărul perioadei Deci aceste elemente
din grupa 14 principală se află
chiar între cele două situații
pentru a ajunge la o configurație
electronică stabilă Ele pot fi
sa cedeze 4 electroni fi să primească
4 electroni sau le mai pot să pună
în comun 4 electroni primele două
elemente din grupă carbonul și
siliciu își obțin configurația
stabilă de octet prin punere în
comuna a celor patru electroni
de valență din marea majoritate
a compușilor lor carbonul au numărul
de oxidare plus 4 carbonul are
în compușii organici numărul de
oxidare maxim caracteristic plus
4 de exemplu în dioxidul de carbon
carbonul are plus patru dar are
și numărul de oxidare plus 2 în
monoxidul de carbon în schimb celelalte
elemente din grupa 14 staniu și
Plumb Bull pot avea și Electro
valență pozitivă adică Ele pot
ceda electroni de valență am discutat
despre asta când a fost vorba despre
variația energiei de ionizare în
grupă cu cât numărul Atomic z este
mai mare Volumul Atomic crește
cu atât electronii de pe ultimul
strat sunt mult mai departe de
nucleu astfel încât electronii
se pot desprinde un pic mai ușor
de înveliș pentru că forța de atracție
a nucleului nu mai este atât de
puternică astfel că deși primele
elemente de grupă prefer să pun
în comun electrodul și staniu pat
și să cedez electroni pentru că
electronilor de valență nu mai
sunt atât de atrași de nucleul
și plumbul sunt situate în perioada
a cincea și a șasea De ce au electroni
de valență pe stratul 5 respectiv
pe stratul 6 și astfel aceste elemente
pot ceda ar fi toți cei patru electroni
de valență e numai doi electroni
adică electroni 5 pe 2 respectiv
electroni 6 pe dos 10 elementele
staniu și Plumb cu cei 4 electroni
de valență ai lor au majoritatea
compușilor pe care îi formează
numărul de oxidare plus 2 și plus
4 Spre exemplu staniul poate forma
a doi oxizi oxidul de staniol în
care are numărul de oxidare plus
doi sau poate forma dioxidul de
staniu în care tara are numărul
de oxidare plus 4 la fel și în
cazul plumbului oxidul de plumb
în care plumbul are plus 2 și dioxidul
de plumb mâncare plumbul are numărul
de oxidare plus 4 în denumirea
compușilor elementelor care pot
avea numere de oxidare diferite
numărul de oxidare se scrie depunând
cifra romană între paranteze Spre
exemplu staniu formează și două
tipuri de cloruri clorura de staniu
2 și clorura de staniu 4 Deci pentru
Scrie denumirea clorurii de staniu
vom scrie clorură de staniu 2 cu
2 cifre romane în paranteză sau
clorură de staniu patru cu patru
cifre romane în paranteză în ceea
ce privește numerele de oxidare
Ale Ale elementelor din grupele
secundare cele 10 Group scurt de
la mijlocul tabelului periodic
lucrurile stau puțin altfel să
ne reamintim că la elementele din
grupele secundare electronului
distinctiv ocupă un substrat mai
în interiorul învelișului electronic
raport cu ultimul strat de aceea
elementele din grupele secundare
pot folosi ca electroni de valență
electronii de valență din stratul
exterior fie electroni din stratul
în care se afle electronul distinctiv
electronul distinctiv adică ultimul
electron care ocupă un orbital
și astfel aceste elemente pot avea
mai multe numele de dare în diverși
compuși chimici În general cu cât
numărul grupei secundare a elementului
e mai mare cu atât acesta a poate
avea mai multe numere de oxidare
să luăm Ca exemplu manganul care
se află în grupa a șaptea secundară
manganul formează compuse și în
care se găsește în stări de oxidare
diferite cu numere de oxidare de
la plus 2 plus 7 în ionul mangan
2 plus din sulfatul de mangan numărul
de oxidare al manganului este plus
doi în dioxidul de mangan numărul
de oxidare al manganului este plus
4 sau Mangalia poate avea numărul
de oxidare plus 7 în permanganatul
de potasiu mai are și alte numere
de oxidare în compuși mai puțin
stati după cum am zis și la început
cunoașterea noțiunii de număr de
oxidare și a semnificației ne va
ajuta foarte mult când vom discuta
despre reacții ba chiar Vom reveni
puțin asupra numerelor de oxidare
mai încolo când vom vorbi despre
reacțiile de oxidoreducere