Variaţia proprietăţilor periodice chimice
Partajeaza in Google Classroom

Transcript
proprietățile chimice periodice
ale elementelor despre care vom
vorbi în continuare sunt electronegativitatea
valența caracterul metalic și caracterul
nemetalic comparând variația acestor
proprietăți în tabelul periodic
se observă o revenire a acestora
de la o perioadă la alta la elementele
din aceeași grupă această periodicitate
se datorează aceluiași număr de
electroni în stratul exterior adică
în stratul de valență în cazul
grupei elementele din aceeași grupă
au aceleași proprietăți chimice
generale pentru început să vedem
ce este electronegativitatea unui
element al poveștii despre cum
atomii vor să ajungă la configurație
stabilă de octet sau duplex asta
se poate întâmpla în două feluri
prin transfer de electroni sau
prin punere în comun D atunci când
pune în comun doi electroni pe
Aceștia se stabilește o legătură
cu Mita legătură covalentă despre
legătura covalentă urmează să vorbim
în lecțiile viitoare în această
legătură covalentă în care doi
atomi parte lectron împărțirea
înmuie egal unui atom vor vin electroni
pentru a mai mult oxigen exemplu
chiar nu dorește mult doi electroni
care sa completeze configurația
de oxigen este un element electronegativ
electronegativitatea unui element
este de fapt puterea cu care un
element a trage electroni dintre
o legătură covalentă electronegativitatea
are chiar și valori numerice Celebrul
Timiș american linus pauling a
determinat electronegativitatea
fiecărui element scara numerică
a electronegativitate are valori
între 0 și patru de elementul cu
valoarea a 4-a trage spre el cu
cea mai mare putere electronic
dintre o legătură cu Valentin aceasta
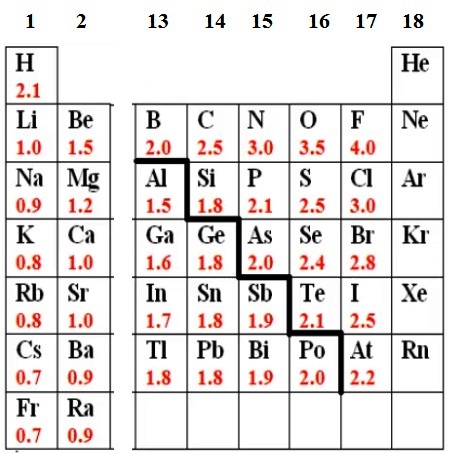
imagine valorile electronegativitatii
lor elementelor din grupele principale
conform lui Paul grupele principale
adică numai elementele din blocurile
echipa Petrolul este cel mai electronegativ
element urmează apoi oxigenul azotul
și clor hidrogenul se află pe la
jumătatea scări majoritatea elementelor
au electronegativitatea mai mică
sau egală cu 1 să vedem acum de
ce fluorul este cel mai electronegativ
element știu părului lipsește un
electron pentru a completa o configurație
de octet si normal ca el să atragă
mai puternic electronii dintre
legătură covalentă așa dar ne dăm
seama că ce mai electronegativ
În ce cărora le mai lipsesc foarte
puțin electroni până la configurația
de octet Adică 1 2 sau chiar trei
electroni dacă vă mai amintiți
tot Aceștia sunt și atomi care
au nevoie de energie foarte mare
dejun bizare pentru a ceda electronegativitatea
variază similar cu energia de ionizare
cu cât un element e mare energie
de ionizare mai mare la fel cel
mai puține electronegativ Martin
sunt atomii elementelor care au
energie de ionizare adică cei care
mai degrabă vor să scape de electroni
De ce nu am nicio problemă din
alte altuia așa dar cu cât e mai
mică energia de ionizare cu atât
mai scăzută și electronegativitatea
cel mai puțin electronegativ Trebuie
să fie un atom care poate realiza
configurația de octet pierzând
foarte ușor un electronice care
are un mare asta pentru că atracția
exercitată de nucleu asupra electronului
care va fi cedat să fie elementele
cu un electron de valență sunt
cele din grupa întâia principală
știind că Pe măsură ce coborâm
în grupă volumul Atomic al elementelor
se mărește pentru că și numărul
straturilor completate cu electroniști
din electronegativ elemente ar
trebui să fie franci franci b un
element din stabil radio activ
așa că pentru procesele chimice
obișnuită Se consideră că cesiunea
este cel mai puțin electronegativ
nmn sau cel mai electropozitiv
la vedem și Ce înseamnă un element
electropozitiv elementele care
au între unu și trei electroni
în stratul de valență au tendința
de a pierde pentru a ajunge la
o configurație electronică astfel
aceste elemente formează Ion Budai
după cum știm din lecțiile trecute
și spunem că aceste elemente sunt
electropozitive să vedem Acum exact
cum variază electronegativitatea
elementelor în tabelul pentru negativitatea
crește în perioadă de la stânga
la dreapta și crește în grupă de
jos în sus spre electronegativitate
e foarte important să reținem că
elementele reacționează cu atât
mai ușor unele cu altele cu cât
diferența de electric evitate dintre
ele este mai mare pătrund electroni
între atomi ești realizează configurații
stabile prin procese din care rezultă
cu un puști capacitatea de combinare
a unui atom cu un alt atom de caracterizat
aprind un număr întreg numit balene
a nu se confunda cu numărul electronilor
de valență sau cu numărul stratului
de valență valența e o proprietate
chimică esențială a elementelor
și variază tot perian Acest lucru
se face observat foarte ușor Analizând
formulele compușilor pe care elementele
chimice le formează în reacția
cu oxigenul adică Analizând oxizii
caracteristici pe care formează
toate elementele dintre opuss tabelul
oxizi elementelor din grupele principale
la fel am prezentat în tabel și
valențele elementelor vedem că
elementele din grupa întâia au
valență auriu iar elementele din
grupa a doua au valență 2 elementele
din grupa 13 au valență A3 de la
grupa 14 până la grupa 17 elementele
au câte două valentich elementele
din grupele de la 14 la 17 Formează
câte două tipuri de obții caracteristici
să luăm Spre exemplu elementele
grupei 14 care formează aceste
două tipuri de carbonul este un
element din grupa 14 iar el formează
dioxidul de carbon și monoxidul
de carbon la fel și staniol lună
element din grupa pai formează
dioxidul de staniu și monoxidul
de elementele din grupa 15 au valențele
5 și 3 iar ele Formează două tipuri
de activ caracteristici cu aceste
formule Așadar azotul din grupa
15 formează oxidul de Daia jos
și trioxidul de diazol și fosforul
unit elemente grupa 15 formează
pentaoxidul de fosfor și trioxidul
de fosfor Iar acest lucru este
valabil pentru toate elementele
din observăm Deci că valența crește
în perioada de la stânga la dreapta
pe baza proprietăților fizice și
chimice elementele din tabelul
periodic se mai tare și vitalitate
elementelor Sunt metale în majoritatea
tabelelor periodice Metalele sunt
despărțite de prinți o linie îngroșată
însă acesta Balvin reprezentată
așa că o Vom desena de la pornește
în jos și se pare Metalele de nemetale
Deci acestea sunt Metalele și acestea
sunt nemetalele iar aceste elemente
care se găsea subliniat sunt considerate
semimetale Haide să vedem care
sunt proprietățile generale ale
metalelor și nemetalelor ia venit
în acest tabel vedem că Metalele
după cum probabil știți deja conduc
foarte bine căldura și electricitatea
în timp ce nemetalele nu conduc
sau conduc partes la căldură și
Metalele sunt maleabile și ductile
adică pot fi trase în foi sau în
fire în timp ce nemetalele nu sunt
nici maleabile și indiciile petalele
au Luciu caracteristici metalice
bineînțeles de Metalele nu au Luciu
metalic Cât despre starea de agregare
Metalele sunt solide la temperatura
camerei cu excepția mercurului
Care este un metal Metalele se
găsesc la temperatura camerei în
toate cele trei stări de agregare
de exemplu carbonul siliciul și
fosforul sunt solid azotul oxigenul
fluorul și gazele nobile sunt în
stare gazoasă iar bromul se găsește
în stare lichidă până aici am discutat
despre proprietățile fizice ale
elementelor în ceea ce privește
proprietățile chimice petalele
sunt caracterizate prin faptul
că au în mod obișnuit între unu
și trei electroni de valență în
timp ce nemetalele au între 4 și
8 electroni de valență petalele
mai sunt caracterizate mai ales
prin tendința de a ceda electroni
formând Ion În ce an a Metalele
au tendința de a accepta electron
formând un negativ Deci care dintre
somn sumadinac să cedeze electroni
dacă ne gândim la ele dacă este
vorba de elementele din partea
stîngă jos academii perian din
aceleași motive pentru care aceștia
Tomi au energie de ionizare foarte
scăzută Pe măsură ce atomii devin
din ce în ce mai mari electronii
de valență sunt tot mai departe
de Forțele de atracție ale nucleului
stupida b10 electronii sunt mai
slabă legați adică mult mai ușor
de Sus din înveliș de aici aceste
elemente care au unul sau doi electroni
de valență în ultimul strat și
care au un volum atomic mare vor
scăpa foarte ușor de aceștia electroni
pentru a forma configurația stabilă
în stratul exterior Așadar aceste
elemente au un caracter metalic
foarte ridicat schimbă elementele
din dreapta sus a tabelului periodic
vor să își păstreze electroni pentru
că eu sunt foarte foarte aproape
de configurația stabilă așa că
ei preferă electroni de aceea e
nevoie de valori ale energiei de
ionizare foarte indicate pentru
a smulge măcar un electron Deci
aceste elemente au un caracter
metalic foarte scăzut sau mai putem
spune că au un caracter nemetalic
foarte pronunțat prin urmare caracterul
metalic crește în grupă de sus
în jos și scadem perioadă de la
stânga la dreapta caracterul nemetalic
variază bineînțeles exact invers
crește în grupă de jos în sus și
scadem perioadă de la dreapta la
stânga mai trebuie precizat un
aspect foarte important legat de
metale și nemetale caracterul metalic
al unui element este asociat caracterului
Buzz Luxi din aur acestui element
exemplu oxidul de calciu calciu
fiind un aliment alcalin la pământ
ohs în reacție cu apa va forma
un hidroxid Adică o bani Deci Acesta
este un comportament dipic al majorității
oxizilor metalici să formezi de
hidroxil reacția cu apă impotriva
nemetalele formează oxidul cu caracter
acid adică oxizi care în reacție
cu apa formează acizi de exemplu
trioxidul de sulf care eu un nemetal
din grupa 16 BA forma în reacția
cu apa acidul sulfuric Deci caracterul
bazic al oxizilor ca deodată cu
caracterul metalic în timp ce caracterul
acid ca deodată cu caracterul nemetalic
să reluăm acum variația proprietăților
chimice periodice despre care am
stat în această lecție electronegativitatea
compus iar în perioadă crește de
la stânga spre dreapta caracterul
metalic crește în grupă de sus
în jos și scadem perioadă de la
dreapta spre stânga sau mai putem
pune problemă și astfel caracterul
nemetalic crește în perioada de
la stânga spre dreapta Acum că
știi mai multe despre atomi și
proprietățile lor generale înțelege
mai bine cum se leagă între ei
nici urmează să vorbim despre legăturile
chimice