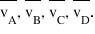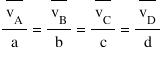Viteza de reacţie
Tag-uri
Partajeaza in Google Classroom

Transcript
atunci când reacție chimică are
loc atomi Sau moleculele se plimbă
prin sistem și din când în când
se ciocnesc dacă ciocnirile au
loc exact așa cum trebuie adică
întru anume partea pomilor și exact
între perechile de atomi sau molecule
care pot reacționa atunci reacția
chimică va avea loc și dacă îndeajuns
de multe molecule sau atomi sistem
reacționează atunci concentrația
reactanților va scădea iar concentrația
produșilor va crește însă o ciocnire
ai fi ca cei care să ducă la o
reacție chimică trebuie să îndeplinească
anumite condiții o moleculă care
se ciocnește de o altă nu duce
neaparat la o reacție chimică cinetică
chimică Este domeniul chimiei care
studiază fixa aceste Ciocârliei
ce mai treci in scama lume plantează
ele viteza de reacție Deci cinetică
a se ocupă cu studiul desfășurării
în timp a reacțiilor chimice sau
cu alte cuvinte ce ocupă cu studiul
vitezelor de reacție am văzut în
capitolul trecut Că termochimia
studiază felul în care inerția
în special energia sub formă de
căldură pariază în sistemele chimice
și am văzut că acest lucru ne arată
În ce condiții unele reacții sunt
termodinamic posibil însă unele
reacții termodinamic posibile de
cur cu viteze foarte mici când
e Ții vă la fermentația alcoolică
durează câteva săptămâni până cât
se formează alcool din struguri
să zicem că dacă vrem să facem
vii Ba unele reacții sunt atât
de linte încât nu sunt deloc cu
tine în practică în timp ce alte
reacții de curcă vitezei atât de
mari încât a Ventura culoa se ia
ceea extrem de important să cunoaștem
factorii care influențează viteza
unei reacții si Cum putem să controlăm
această caracteristică și încă
la mecanică definim viteza Medi
de deplasare prin următorul raport
avem viteza medie de deplasare
a unui obiect mobil pe o distanță
Delta de în intervalul de timp
Delta t iar Delta de este diferența
dintre distanța finală și distanța
inițială Deci distanța este mărimea
care variază o dată cu deplasare
obiectului iar Delta t este variația
timpului la fel ca și alte procese
care se desfășoară în timp și reacțiile
chimice sunt caracterizate prin
viteză pe care o numim viteză de
reacție am văzut la începutul lecției
că atunci când are loc o reacție
chimică înseamnă că descrește concentrația
reactanților și crește concentrația
produșilor de reacție Așadar vedem
că în cazul reacțiilor chimice
mărimea care variază în timp este
concentrația și anume concentrația
react sau concentrația produșilor
de reacție astfel definind viteza
medie de reacție întru interval
de timp Delta t prin acest raport
Delta si supra de stat A deci viteza
medie de reacție reprezintă variația
concentrației un reactant sau a
unui produs de reacție în unitatea
de timp iar unitatea de măsură
pentru viteza de reacție este moli
pe litru adică concentrație totul
supra secundă aici loc de secundă
putem avea și minut sau o oră o
funcție de unitatea în care vrem
să exprimăm timp moli pe litru
totul supra secundă înseamnă de
fapt moli pe litru ori secundă
sau Mall ori a la puterea minus
1 ori is la minus putem exprima
viteza medie de reacție funcție
de concentrație a unui reactant
funcție de concentrația unui produs
de reacție Haideți să vedem acum
cum putem reprezenta grafic variația
acestor concentrații ce avem în
acest grafic variația concentrației
unui reactant curba roșie și a
unui produs de reacție curba albastră
în funcție de Timp Aceasta este
reprezentarea grafică a ceea ce
am zis mai devreme măsură ce o
reacție chimică se desfășoară concentrația
de accentului scade 1 iar a produsului
crește să alegem pe graficul în
timp de 1 timpul inițial al reacției
și un timp de 2 mo mentul lui T1
îi corespunde o concentrației reactantului
cât și o concentrație inițială
a produsului la momentului te 2
îi corespunde o concentrație finală
a reactantului și o concentrație
finală a produsului e clar de pe
grafic să avem concentrația inițială
a reactantului mai mare decât cea
finală la fel vedem de pe grafic
că avem concentrația inițială a
produsului mai mică decât cea finală
astfel când exprimăm viteza medie
de reacție în funcție de concentrația
reactantului aceasta va avea o
valoare negativă o valoare mai
mică decât 0 asta pentru că această
concentrație are accentului scade
în timp când exprimăm viteza medie
de reacție în funcție de concentrația
produsului aceasta va avea o valoare
pozitivă Deci mai mare decât 0
concentrația produsului de reacție
crescând în timp însă pentru ca
viteza de rea ar fi să fie întotdeauna
pozitivă calculăm viteza medie
de reacție în funcție de concentrația
reactantului în acest fel adăugăm
un minus în fața variației de concentrație
De ce minus cu minus îl de la Delta
cer o să ne dea o valoare pozitiva
în continuare Haideți să luăm Ca
exemplu o reacție de tipul acesta
unde a și b sunt reactanți iar
c și d sunt produși pentru această
reacție vom avea 4 viteze de reacție
care descriu aceeași reacție vitezele
medii ale reactanților a și b și
vitezele medii ale produșilor c
și d există o relație matematică
între aceste viteze de reacție
Ce anume această relație unde va
este viteza medie calculată în
funcție de concentrația compusului
a iar mi este coeficientul stoichiometric
al compusului ce tot așa și pentru
compușii b c și d Haideți să luăm
un exemplu să verificăm egalitatea
între aceste raporturi avem aici
ecuația reacției de descompunere
a pentaoxidului de diazol pentru
această reacție cunoaștem următoarele
date pentru reactant și pentru
unul dintre produșii de reacție
vedem că reacția începe cu o anume
concentrație de reactant pentru
oxid de diazot dar în momentul
zero înainte care să aibă loc nu
există în sistem nici un produs
de reacție Deci concentrația dioxidului
de azot este 0 Pe măsură ce trece
timpul și reacția evoluează vedem
cum Scade concentrația pentaoxidului
și crește concentrația de oxidului
de azot Haideți să calculăm vitezele
medii de reacție pentru acești
compuși Balul de timp de două patru
ore în Oradea și înnorat randul
nostru este egală cu variația concentrației
în intervalul de timp pe care îl
am ales ce să nu uităm că fin reactant
avem semnul minus în fața raportului
pentru a obține o valoare pozitivă
Deci avem concentrația în momentul
final minus concentrația în momentul
inițial din intervalul care ne
interesează și totul supra 2 minus
1 înlocuind cu valorile numerice
corespunzătoare din tabel în A4
oră a reacției avem o concentrație
de pe tau si de diazot de 0 moli
pe litru iar în a doua oră a reacției
avem o concentrație de 0 moli pe
litru și totul supra patru ore
minus două ore efectuând calculul
și am obținut o viteză medie de
0 moli pe litru ori oră și la fel
calculăm și viteza medie în funcție
de dioxidul de azot Care este un
produs de reacție în acest caz
nu mai avem nevoie de semnul minus
în fața raportului efectuăm calculul
cu valorile corespunzatoare din
tabel și obținem o viteză de reacție
de 0 moli pe litru ori oră Acum
că am calculat valorile acestor
viteze medii de reacție Putem verifica
relația de care vorbeam mai devreme
deci să vedem dacă aceste raporturi
sunt egale 2 și 4 sunt coeficienții
de reacție corespunzători din ecuația
reacției am avea primul raport
egal cu 0 95 și al doilea raport
este egal tot cu 0 95 vedem Așadar
Că întradevăr este egalitate între
aceste rapoarte care descriu aceeași
reacție după cum am zis și la începutul
lecției unele reacții au viteze
foarte mari și sunt instantanee
iar altele au viteze foarte mici
așa dar putem clasifica reacțiile
chimice în funcție de viteza de
reacție reacțiile rapid sunt cele
care au un timp de reacție foarte
scurte câteva secunde viteza acestor
reacții este determinată Mai degrabă
de viteza cu care reactantii difuzează
până când vine în contact Deci
când vine contactul reacționează
imediat rapid sunt reacțiile dintre
Ion sau reacțiile dintre acizi
și baze avem de exemplu această
reacție dintre acidul clorhidric
și hidroxidul de sodiu alte reacții
care au loc extrem de repede sunt
reacțiile de combustie ale unor
hidrocarburi care pot de curge
chiar și cu explozie apoi avem
reacțiile cu viteză moderată care
au un timp de reacție relativ scurte
câteva minute de exemplu reacția
dintre zinc și o soluție de acid
clorhidric durează câteva minute
până când se degajă hidrogenul
formate reacții reacțiile lente
sunt reacțiile cu timp de reacție
mai lung de câteva ore sau chiar
câteva zile de obicei reacții lente
sunt reacțiile în care se desfac
sau se formează legăturile covalente
legăturile covalente se desfac
mai greu iar moleculele formate
din astfel de legături prezintă
o anumită inerție chimică de exemplu
combustibili detergenții alimentele
și multe alte substanțe organice
pot fi păstrate în contact cu oxigenul
din aer numai datorită inerției
moleculelor care le formează un
exemplu de reacție lentă este ruginirea
fierului cu toții știm că Durează
destul de mult timp până când apar
petele de rugină Sau dacă vreți
exemplul unei reacții extrem extrem
de lent a gândiți voi la combustibili
fosili se știe deja că riscăm ca
în câteva decenii să îi pui ism
toate resursele de cărbune petrol
și gaze naturale și acest lucru
reprezintă o problemă majoră pentru
toată omenirea pentru ca aceste
resurse nu sunt regenerabile asta
pentru că a durat între câteva
milioane sute de milioane de ani
pentru ca plantele și animalele
acvatice de pe vremea aceea să
se transforme în combustibil fosil
Așadar vedem că reacția decarbonizare
a plantelor și animalelor este
una extrem de lent și din această
cauză una din principalele preocupări
ale oamenilor de știință la ora
actuală este dezvoltarea tehnologiilor
care produc energie cu ajutorul
lunar resurse regenerabile cu soarele
sau vântul de aceasta am văzut
că baza cineticii chimice stă în
concentrațiile reactanților și
ale produșilor la diferite momente
după ce o reacție a fost inițiată
viteza de reacție este determinată
experimental ea nu poate fi calculată
din variației energiei sau din
variație a oricărui azi Factor
termodinamic există mai multe tehnici
de măsurare a vitezelor de reacție
între care spectrofotometria spectroscopia
de emisie spectroscopia de masă
sau rezonanța magnetică nucleară
rezultatele acestor măsurători
arată că vitezele de reacție depind
în trupele caracteristic de concentrațiile
reactanților și de concentrațiile
produșilor și pot fi exprimate
prin anumite ecuații care sunt
de fapt expresii ale legii vitezei
de reacție cinetică chimică se
ocupă cu determinarea vitezelor
de reacție de unde derivă legea
vitezei de reacție și constantele
de viteză despre toate acestea
a vom vorbi mai în detaliu întruna
din lecțiile următoare

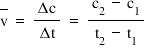

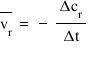
 cC + dD
cC + dD