Zirconiul, Zr, este un metal de tranziție lucios, cu aspect de oțel din grupa 4 a tabelului periodic (grupa a IV-a secundară sau grupa IV B); are numărul atomic 40 și masa atomică 91,22. Zirconiul are punctul de topire la 1852°C și punctul de fierbere la 4377°C. Principalele surse de zirconiu sunt minereurile bedeleit și zircon.
Zirconiul este răspândit în natură pe toată suprafața pământului, dar în cantități mici, mai ales sub formă de bedeleit (o formă de dioxid de zirconiu, ZrO2) sau de zircon (silicat de zirconiu, ZrSiO4). Unele minerale de zirconiu apar și în aluviuni (alături de ilmenit, rutil și monazit).
Zirconiu se obține din concentratele de minereuri sau de nisipuri aluvionare. Industrial, se prepară ca și titanul, din dioxid de zirconiu tratat cu clor și cărbune, când rezultă tetraclorura de zirconiu care este apoi redusă cu magneziu topit, la circa 800°C, în atmosferă de argon.
Zirconiul de mare puritate se obține de asemenea similar titanului prin descompunerea termică a tetraiodurii de zirconiu, în vid, pe filament incandescent.
În stare compactă zirconiul este un metal lucios, asemănător oțelului. În formă de pulbere arde ușor în oxigen, pe cînd în stare compactă, la calcinare, este oxidat numai superficial.
Apa și hidroxizii alcalini nu reacționează cu zirconiul nici la cald. Nici acidul clorhidric sau acidul azotic nu reacționează la cald cu zirconiul sub formă compactă. Este atacat numai de acidul sulfuric de 60% la cald. Ca și titanul, zirconiul formează o nitrură, ZrN, o carbură, ZrC și o siliciură, ZrSi2. În stare de pulbere poate absorbi cantități mari de hidrogen.
Sunt cunoscuți 5 izotopi naturali ai zirconiului (cu numere de masă 90, 91, 92, 94 și 96) și 6 izotopi radioactivi.
Sub formă de aliaj cu fier, ferozirconiu, zirconiul este folosit pentru îndepărtarea azotului sau a oxigenului din topiturile oțelurilor speciale. Adăugat aluminiului, zirconiul îl face mai rezistent față de apa de mare; adăugat cuprului, îi mărește rezistența mecanică.
Zirconiul de înaltă puritate este folosit ca material pentru protecția barelor de uraniu în reactorul atomic, deoarece nu captează neutroni termici.
În combinațiile sale, zirconiul are numărul de oxidare patru; numai în rare cazuri are numere inferioare de oxidare (combinațiile respective sunt reducătoare).
Combinațiile de Zr(IV) sunt incolore. Sărurile neutre pot hidroliza în soluție apoasă formând săruri de zirconil, ZrOX2:
Zr4+ + H2O 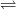 [ZrO]2+ + 2H+
[ZrO]2+ + 2H+
Când hidroliza este completă precipită dioxidul de zirconiu, ZrO2, sau hidratul acestuia:
Zr4+ + 2H2O 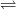 ZrO2 + 4H+
ZrO2 + 4H+
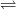 [ZrO]2+ + 2H+
[ZrO]2+ + 2H+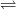 ZrO2 + 4H+
ZrO2 + 4H+





