Răspândire în natură. Plumbul se găsește mult răspândit în natură sub formă de combinații. Cele mai însemnate minereuri de plumb sunt
galena (sulfura de plumb, PbS),
ceruzitul (carbonatul de plumb, PbCO
3), care este un produs de descompunere a galenei, ca și
anglezitul (sulfatul de plumb, PbSO
4).
Zăcăminte bogate de combinații de plumb se găsesc în Australia, Canada, Germania și Rusia.
Aproape întotdeauna minereurile de plumb sunt polimetalice, adică conțin și alte metale, de exemplu zinc.
Plumbul este produsul final al celor trei serii radioactive; deoarece masa atomică a plumbului din minerale radioactive variază, valoarea ei indică originea plumbului.
Obținere. Plumbul se extrage din galenă. În prealabil, aceasta trebuie îmbogățită, ceea ce se face de obicei prin
flotație. Flotația este una dintre cele mai utilizate metode pentru a mări concentrația minereului de bază și a micșora cantitatea de impurități. Această metodă se bazează pe adeziunea selectivă a particulelor minerale la suprafața de separare a două faze.
Extragerea plumbului din galenă se face după trei procedee:
Procedeul prin prăjire și reducere constă în trecerea unui curent de aer printr-un cuptor în care se găsește galena. În prima etapă, prin prăjire, la 500-600°C, sulfura de plumb este transformată în oxid de plumb:
2PbS + 3O2 = 2PbO + 2SO2
În a doua etapă a procesului, în furnale, la 1400-1500°C, oxidul de plumb este redus cu cocs și cu oxidul de carbon format prin arderea cocsului:
PbO + C = Pb + CO
PbO +CO = Pb + CO2
Curentul de aer insuflat în cuptor trebuie astfel potrivit, încât sulfura să nu fie oxidată până la sulfat:
PbS + 2O2 = PbSO4
deoarece, în etapa de reducere, sulfatul va trece din nou în sulfură de plumb. Pentru a împiedica această reacție se adaugă dioxid de siliciu:
2PbSO4 + 2SiO2 = 2PbSiO3 + 2SO2 + O2
Silicatul de plumb format nu este redus direct de către cocs; datorită oxidului de calciu adăugat concomitent se formează întâi oxid de plumb, care reacționează apoi cu oxidul de carbon:
PbSiO3 + CaO = PbO + CaSiO3
PbO + CO = Pb + CO2
Procedeul prin prăjire și reacție se aplică minereurilor bogate în plumb și sărace în silice. În prima etapă, numai o parte din sulfură este prăjită la oxid de plumb. În a doua etapă, restul de sulfură de plumb reacționează cu oxidul de plumb (și sulfatul de plumb eventual format), la temperatura de 800-900°C, în absența aerului:
PbS + 2PbO = 2Pb + SO2
PbS + PbSO4 = 2Pb + 2SO2
Dioxidul de sulf rezultat este folosit la fabricarea acidului sulfuric.
Procedeul prin precipitare, care constă în tratarea sulfurii de plumb cu fier (obținut prin reducerea oxidului de fier cu cocs, introduși concomitent în cuptor) are aplicație mai limitată:
PbS + Fe = Pb + FeS
Plumbul obținut, indiferent de metodă, conține ca impurități: arsen, stibiu, staniu, zinc, cupru etc., care îi modifică proprietățile. De aceea, el trebuie rafinat. Plumbul pur, necesar fabricării acumulatoarelor și diferiților pigmenți, se obține prin rafinare electrolitică.
Dacă între impuritățile plumbului se găsește argint în cantități mai mari (până la 1%), extragerea lui constituie un procedeu de obținere a argintului.
Proprietăți fizice. Plumbul este un metal cu luciu cenușiu-albăstrui în tăietură proaspătă; la aer se acoperă însă imediat cu un strat de oxid de culoare cenușie. Este maleabil și ductil și se poate tăia cu cuțitul, fiind cel mai moale dintre metalele grele. Pe hârtie lasă urme, din care cauză s-a întrebuințat înainte vreme pentru scris. Mici cantități din alte metale (Fe, Zn, Cu) fac plumbul sfărâmicios; stibiul îi mărește duritatea.
Plumbul are o slabă conductibilitatea termică și electrică.
Dacă se separă plumbul din sărurile sale (din azotat sau acetat), fie electrolitic, fie cu zinc, se formează ace lungi octaedrice. Astfel, dacă într-o soluție de acetat de plumb se introduce o tablă de zinc, după un timp, aceasta se acoperă cu cristale de plumb, care îi dau un aspect de arbore (“arborele lui Saturn”).
Plumbul topit se acoperă la suprafață cu un strat de oxid, care la încălzire mai îndelungată trece în litargă, PbO, de culoare galbenă, iar apoi, când aerul este în cantitate suficientă, în miniu, Pb3O4, de culoare roșie.
Plumbul se combină și cu halogenii, cu sulful, seleniul și cu telurul.
Deși plumbul este așezat înaintea hidrogenului în seria tensiunilor electrochimie, el nu este în general atacat de acizi diluați, datorită formării la suprafață a unei pelicule insolubile protectoare; astfel, în contact cu acidul sulfuric se formează un strat de sulfat de plumb, PbSO4, insolubil în acid concentrat (proprietate importantă, pentru întrebuințarea plumbului în industria acidului sulfuric “de cameră”).
În prezența aerului, plumbul poate fi atacat însă și de acizii diluați, când se formează oxid de plumb, care apoi trece în starea respectivă:
2Pb + O2 = 2PbO
PbO + 2H+ = Pb2+ + H2O
Plumbul poate fi atacat chiar și de apă, cu care formează hidroxid de plumb:
2Pb + O2 + 2H2O = 2Pb(OH)2
Dacă apa de ploaie conține dizolvată o cantitate suficientă de aer și dioxid de carbon, ea atacă plumbul la suprafață, formând un carbonat bazic de plumb, care se dizolvă în apă; apa de izvoare și de râuri, care conține și sulfați în soluție, formează pe suprafețele de plumb un strat superficial de sulfat de plumb insolubil, care împiedică atacul ulterior al plumbului. Din cauza acestei comportări, plumbul folosește la confecționarea conductelor de apă potabilă.
Plumbul este atacat de hidroxizi alcalini, rezultând plumbați (II).
Proprietăți biologice. Plumbul, fie ca atare, fie în combinații, are o acțiune otrăvitoare asupra organismului. Otrăvirile cu plumb, numite saturnism, se recunosc după paloarea feței, căderea dinților, a părului, dureri musculare, colici, paralizii.
Utilizare. Plumbul este unul dintre metalele cele mai întrebuințate. Din plumb se confecționează conducte de apă, camere de plumb și instalații auxiliare în industria acidului sulfuric, căptușeli antiacide pentru aparate și rezervoare în care se păstrează lichide acide și gaze agresive, cămăși pentru îmbrăcarea cablurilor electrice, etc.
Deoarece absoarbe bine radiațiile
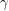
, plumbul se utilizează pentru plăci de protecție față de aceste radiații, atunci când se lucrează cu aparate Roentgen.
Cantități mari de plumb sunt folosite la fabricarea electrozilor pentru acumulatoare electrice.
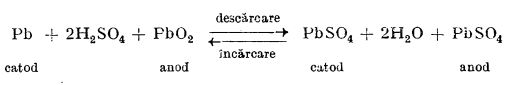
În acumulatoare, energia electrică este transformată în energie chimică, și invers; deci, la funcționarea acumulatorului se deosebesc: încărcarea și descărcarea.
Acumulatorul cu plăci de plumb. Acumulatorul cu plăci de plumb este alcătuit, în principiu, din doi electrozi formați dintr-o rețea de plumb.
La anod, spațiile rețelei sunt umplute cu dioxid de plumb, PbO
2, iar la catod cu plumb spongios. Electrozii sunt introduși într-o soluție de acid sulfuric de 22-28%; ei se acoperă imediat cu un strat de sulfat de plumb. Când electrozii sunt legați de o sursă de curent continuu, adică se procedează la încărcarea acumulatorului, atunci la polul negativ, electronii din sursa electrică reduc sulfatul de plumb la plumb metalic:
Pb2+SO4 + 2e- = Pb0 + SO42-
La catod, prin cedare de electroni, plumbul trece de la la numărul de oxidare +2, la numărul de oxidare +4, adică sulfatul de plumb (II) trece în sulfatul de plumb (IV), care este solubil în apă și hidrolizează; ca rezultat al hidrolizei se formează dioxid de plumb și acid sulfuric:
Pb(SO4)2 + 2H2O = PbO2 + 4H+ + 2SO42-
În timpul funcționării acumulatorului, sensul curentului este inversat, adică se produce descărcarea; o parte din plumbul metalic de pe catod trece în soluție sub formă de ioni Pb2+.
Pb = Pb2+ + 2e-
Electronii trec la anod, unde reduc plumbul de la numărul de oxidare +4 la numărul de oxidare +2:
Pb4+ + 2e- = Pb2+
Ionii Pb2+ formați pe ambii electrozi se combină cu ionii SO42- din soluție și formează sulfat de plumb, insolubil:
Pb2+ + SO42- = PbSO4
Rezumat, procesul chimic din acumulator poate fi redat prin ecuația:
De aici provine denumirea de teoria dublei sulfatări, prin care se explică procesul.
Aliaje de plumb. Plumbul fiind foarte moale se aliază de obicei cu stibiul. Aliajele Pb-Sb, care conțin 0,3-30% Sb, numite
plumb antimonos sau
plumb tare, spre a fi diferențiate de plumbul moale, adică de plumbul pur, se utilizează pentru confecționarea de gloanțe, plăci de acumulator, etc.
La lipirea metalelor grele și a aliajelor lor se folosesc aliajele de cositor pentru lipit (10-80% Pb, 20-90% Sn). Alte aliaje de plumb mult utilizate sunt: aliajele tipografice (65% Pb, 5-20% Sb, 2-7% Sn), compozițiile pentru lagăre (71-77% Pb, 11-18% Sb, 6-8% Sn, eventual 1-6% Cu) etc. Cu mercurul, plumbul formează amalgame.
În combinațiile sale, plumbul are numărul de oxidare +2 și +4, combinațiile plumbului (IV) fiind mai puțin stabile.
Combinațiile de plumb (II) sunt de obicei ionice, adică săruri ale ionului Pb2+, care se aseamănă cu sărurile ionului Sn2+. Ele au tendința să adiționeze oxid sau hidroxid de plumb formând săruri bazice, de exemplu carbonatul bazic de plumb Pb3(OH)2(CO3)2.
Combinațiile plumbului (IV) sunt de obicei covalnete și se aseamănă cu combinațiile analoage ale staniului, germaniului și siliciului. Astfel, plumbul (IV) formează cu hidrogenul o combinație volatilă, hidrura de plumb, PbH4, precum și combinații cu radicali organici, alchilii de plumb, PbR4, de exemplu tetraetilul de plumb, Pb(C2H5)4.
Ca ioni pozitivi, plumbul (IV) apare numai în soluții apoase, în concentrații reduse, însă are tendința să formeze cu ionii în exces anioni complecși. De exemplu, de la tetraclorura de plumb, PbCl4, derivă ionul cloroplumbat, [PbCl6]2-.
Tendința sărurilor de plumb (IV) să treacă în săruri de plumb (II) este mai mare decât la staniu, din care cauză sărurile de plumb (II) nu sunt reducătoare, cum sunt cele de staniu (II); în schimb, combinațiile plumbului (IV) au caracter oxidant.
Cu oxigenul, plumbul formează: oxidul de plumb, PbO, dioxidul de plumb, PbO2, și miniul, Pb3O4 (care se mai numește și roșu de plumb sau roșu de Saturn).
Oxidul de plumb sau
oxidul de plumb (II), PbO, este o pulbere galbenă-roșiatică, ce se obține industrial pe cale uscată, prin trecerea aerului peste plumb topit, sau pe cale umedă, prin fierberea hidroxidului de plumb cu hidroxid de sodiu. Se prezintă în două modificații: una roșie (
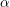
) care cristalizează în sistemul tetragonal (
litarga), și una galbenă (
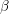
), care cristalizează în sistemul rombic (
masicot). Temperatura de transformare a celor două modificații nu este bine cunoscută.
Prin încălzire la aer, oxidul de plumb trece în miniu. Unii reducători, cum sunt hidrogenul, carbonul, oxidul de carbon, îl reduc la plumb metalic.
Oxidul de plumb este insolubil în apă: reacționează ușor cu acizii formând săruri, iar dintre baze reacționează numai cu hidroxizii alcalini concentrați formând hidroxoplumbați (II).
Oxidul de plumb este utilizat pentru fabricarea sticlelor speciale de plumb (cristal, flint, strass), a glazurilor, în ceramică, a vernisurilor, vopselelor, etc precum și la prepararea unor săruri de plumb.
Oxidul de plumb hidratat, PbO·
xH
2O, considerat în mod obișnuit
hidroxid de plumb (II) și notat Pb(OH)
2, rezultă prin tratarea sărurilor de plumb (II), solubile, cu hidroxizi alcalini. Deshidratat, trece în oxid de plumb, roșu sau galben, după cum deshidratarea s-a făcut la 100°C sau la temperaturi mai mici. Ca și hidroxidul de staniu, are caracter amfoter. Reacționează cu acizi tari formând săruri de plumb (II), ca de exemplu:
Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2H2O
Iar cu hidroxizii alcalini formează hidroxoplumbați (II):
Pb(OH)2 + NaOH = Na[Pb(OH)3
Dioxidul de plumb sau
oxidul de plumb (IV), PbO
2, se obține prin oxidarea unei sări de plumb (II), cu un hipoclorit alcalin sau clorură de var, sau pe cale electrolitică. Este o pulbere brună insolubilă în apă. Prin topire cu hidroxizi alcalini formează
hexahidroxoplumbați, M
I2[Pb(OH)
6].
Prin încălzire, dioxidul de plumb se descompune în oxid de plumb și oxigen (este oxidant). Frecat cu substanțe inflamabile, cum este fosforul roșu sau sulfuri, le aprinde. De aceea se adaugă ca oxidant în compoziția chibriturilor.
Miniu de plumb, Pb
3O
4, poate fi considerat ca rezultat prin combinarea oxidului de plumb cu dioxidul de plumb:
2PbO + PbO2 = Pb2[PbO4]
adică ar fi un tetroxoplumbat (IV) de plumb (II). Dovadă că conține un atom de plumb (IV) și doi atomi de plumb (II) este faptul că prin tratare cu acid azotic se transformă într-un amestec de azotat de plumb (II) și dioxid de plumb:
Pb3O4 + 4HNO3 = 2Pb(NO3)2 + PbO2 + 2H2O
Miniul se obține prin încălzirea oxidului de plumb, în curent de aer la 500°C. Este o pulbere de culoare roșie intensă, insolubilă în apă și în dizolvanți organici. Peste 585°C se descompune:
2Pb2[PbO4] ⇄ 6PbO + O2
Miniul este foarte mult utilizat în pictură pentru culoarea lui roșie intensă, în industrie pentru vopsele de ulei (care protejează obiectele metalice pe care sunt aplicate), la prepararea unor chituri, la fabricarea de linoleum, în industria cauciucului și explozivilor, a bateriilor electrice, în metalurgie, medicină etc.
Dintre sărurile de plumb, mai importante sunt cele ale plumbului (II). Ele se obțin de obicei din oxid de plumb sau plumb metalic. Prin tratare cu acid azotic sau acid acetic se formează azotatul sau acetatul de plumb, care sunt săruri solubile. Sărurile de plumb insolubile se obțin din săruri de plumb solubile (azotat sau acetat) prin reacții de dublu schimb.
Acetatul de plumb (II), Pb(CH
3COO)
2, este un produs cristalin, cu gust dulceag (de unde și numele de zahăr de plumb), foarte toxic. Dacă în soluțiile apoase apoase de acetat de plumb se introduc cantități de oxid de plumb rezultă
acetați bazici, ca de exemplu Pb(OH)(CH
3COO). Acetatul de plumb este folosit în industria textilă (imprimerie vopsitorie), precum și în medicină.
Carbonatul de plumb (II), PbCO
3, se găsește în natură sub forma mineralului
ceruzit. Se poate prepara prin trecerea unui curent de dioxid de carbon printr-o soluție diluată de acetat de plumb sau prin tratarea unei sări solubile de plumb cu carbonat de amoniu sau de sodiu:
Pb(NO3)2 + Na2CO3 = PbCO3 + 2NaNO3
Carbonatul de plumb este o substanță albă, cristalină, foarte puțin solubilă în apă. Prin încălzire se descompune în oxid de plumb și dioxid de carbon.
Carbonatul bazic de plumb, Pb(OH)2·2PbCO3, se prepară prin diferite metode care se bazează în principiu pe acțiunea dioxidului de carbon asupra acetaților bazici solubili, rezultați la rândul lor prin atacarea plumbului cu acid acetic și aer.
Este o pulbere albă, amorfă, care cu uleiul de in formează vopsele cu o bună putere de acoperire. Aceste vopsele prezintă însă inconvenientul că sunt toxice, iar cu urmele de hidrogen din atmosferă formează sulfura de plumb, PbS, neagră.
Sulfatul de plumb (II), PbSO
4, se găsește în natură sub forma mineralului
anglezit. Se prepară tratând săruri de plumb solubile cu acid sulfuric diluat. Este o substanță albă, practic insolubilă în apă.
Sulfura de plumb (II), PbS, se găsește în natură sub formă de
galenă, cristale octaedrice sau cubice de culoare cenușie, cu luciu metalic. Se poate prepara prin încălzirea plumbului în vapori de sulf sau, sub formă de precipitat negru, prin tratarea unei sări de plumb solubile cu hidrogen sulfurat.
Prin încălzire în aer, sulfura de plumb este oxidată la sulfat de plumb și oxid de plumb, reacție care stă la baza obținerii plumbului.
Prin încălzire în curent de hidrogen, sulfura de plumb cu degajare de hidrogen. Acidul azotic diluat o oxidează la sulf:
3PbS + 8HNO3 = 3Pb(NO3)2 + 2NO + 2S + 4H2O
Cristalele de sulfură de plumb sunt folosite în radiofonie.