Acidul clorhidric, HCl, este o soluție de clorură de hidrogen gazoasă în apă; este un lichid otrăvitor, înțepător și este un acid mineral tare, care disociază complet în soluție.
Răspândire în natură
Acidul clorhidric este foarte puțin răpândit în natură; se găsește doar în cantități minime în gazele emanate de vulcani sau dizolvat în apa râurilor care vin din regiunile vulcanice.
În sucul gastric al animalelor și oamenilor se găsesc cantități foarte mici de acid clorhidric (0,30%), care ajută începerea procesului de digestie și apără organismul de unele infecții provocate de bacterii introduse odată cu alimentele.
Preparare
În laborator, acidul clorhidric se obține în mod obișnuit prin acțiunea acidului sulfuric asupra clorurii de sodiu, la încălzire:
NaCl + H2SO4  NaHSO4 + HCl
NaHSO4 + HCl
Acidul clorhidric fiind gaz, se degajă din amestecul de reacție pe măsură ce se formează, astfel încât reacția se desfășoară de la stânga spre dreapta.
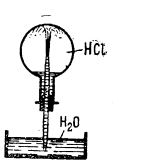
Prepararea acidului clorhidric poate fi efectuată într-un balon (ilustrat în figura de mai jos), în care se introduce o cantitate de clorură de sodiu măcinată; balonul se închide cu un dop, iar prin pâlnie, se adaugă, cu atenție, acid sulfuric (raport 3 : 2). Balonul se încălzește; se degajă acid clorhidric gazos, care se colectează într-un balon sau vas.
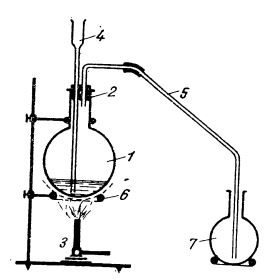
Dispozitiv pentru prepararea acidului clorhidric în laborator:
1 - balon;
2 - dop;
3 - bec de gaz;
4 - pâlnie;
5 - tub de legătură;
6 - pânză metalică cu azbest;
7 - vas pentru colectarea acidului clorhidric gazos.
acidul clorhidric se prepară după mai multe metode, materia primă fiind fie clorura de sodiu, fie clorul.
a) Prepararea acidului clorhidric prin acțiunea acidului sulfuric asupra clorurii de sodiu. Procesul are loc în două etape. În prima etapă, la o temperatură de circa 450°C, rezultă sulfat acid de sodiu:
NaCl + H2SO4  NaHSO4 + HCl
NaHSO4 + HCl
Sulfatul acid de sodiu reacționează apoi la o temperatură mai înaltă, de circa 700°C, cu altă cantitate de clorură de sodiu:
NaHSO4 + NaCl  Na2SO4 + HCl
Na2SO4 + HCl
Reacția globală care se produce în cuptor între clorura de sodiu și acidul sulfuric este:
2NaCl + H2SO4  2HCl + Na2SO4
2HCl + Na2SO4
În afară de acid clorhidric se obține sulfat de sodiu ca subprodus.
b) Prepararea acidului clorhidric prin sinteză:
H2 + Cl2  2HCl
2HCl
Aceasta este o metodă care tinde din ce în ce mai mult să înlocuiască celelalte procedee întrucât prezintă avantajul că folosește hidrogenul și clorul rezultate concomitent la electroliza clorurii de sodiu.
Reactorul (soba) pentru sinteza acidului clorhidric este format dintr-un tub de cuarț sau de oțel (ilustrat în figura de mai jos) în care intră două țevi concentrice ce formează arzătorul. Prin una dintre țevi se introduce clorul și prin cealaltă hidrogenul, ambele gaze fiind sub presiune. Hidrogenul arde în clor cu o flacără foarte caldă (de aproape 2000°C); acidul clorhidric format trece în coloanele de absorbție. Prin acest procedeu se obține un acid clorhidric foarte pur.
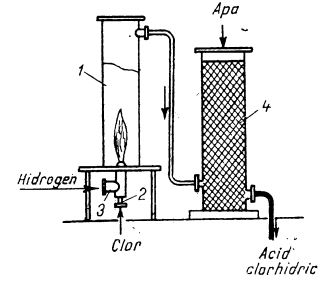
Schema instalației pentru fabricarea acidului clorhidric prin sinteză:
1 - sobă pentru arderea hidrogenului;
2 - intrarea clorului în cuptor;
3 - intrarea hidrogenului în cuptor;
4 - coloană de absorbție.
Prepararea soluției de acid clorhidric
În mod obișnuit, acidul clorhidric se folosește sub formă de soluții concentrate. Pentru dizolvare se folosesc tuburi de absorbție din cuarț în formă de S, așezate unul deasupra altuia, formând un turn, în care apa circulă de sus în jos, întâlnind acidul clorhidric gazos în contracurent (ilustrat în figura de mai jos). Soluția de acid clorhidric are o concentrație uzuală de aproximativ 36% HCl (
d = 1,19).
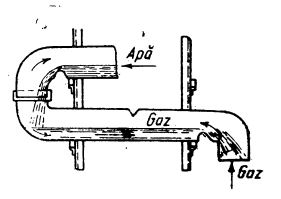
Tuburi de absorbțe în formă de S, din cuarț sau metalice.
Depozitarea și transportul soluției de acid clorhidric se face în damigene de sticlă, în vase de ceramică sau în rezervoare de oțel căptușite cu cauciuc. Acidul clorhidric gazos se comprimă în tuburi de oțel.
Acidul clorhidric este un gaz incolor, cu miros înțepător. Se lichefiază la -84,9°C și se solidifică la -114,8°C. El este de 1,3 ori mai greu decât aerul, din care cauză poate fi cules în vase ținute cu gura în sus. Un litru de acid clorhidric gazos cântărește 1,64 g. Se poate lichefia cu ușurință.
Acidul clorhidric este foarte solubil în apă, cu dezvoltare de căldură; la temperatura obișnuită, un volum de apă dizolvă circa 450 volume acid clorhidric.
Astfel, dacă un balon de sticlă umplut cu acid clorhidric gazos și astupat cu un dop străbătut de un tub de sticlă (ilustrat în figura de mai jos) se răstoarnă introducând tubul de sticlă în apa dintr-un cristalizator (căreia i s-au adăugat câteva picături de soluție de turnesol albastru), acidul clorhidric se dizolvă în apă, producând un vid în interiorul balonului; apa se urcă prin aspirație în balon, țâșnind puternic prin vârful deschis al tubului. În același timp culoarea turnesolului se schimbă din albastru în roșu.
Solubilitatea HCl în apă
În contact cu aerul, acidul clorhidric în soluție concentrată (sau cel gazos) răspândește o ceață formată din picături mici de soluție de acid clorhidric rezultate prin dizolvarea în vaporii de apă din aer, a acidului clorhidric gazos. De aceea, acidul clorhidric foarte concentrat se mai numește și acid clorhidric fumans.
La fierberea unei soluții saturate de acid clorhidric distilă vapori mai bogați în acid decât soluția; în modul acesta concentrația lichidului scade, iar punctul de fierbere crește. La 110°C distilă un acid clorhidric de compoziție constantă 20,2% HCl. Tot așa, la fierberea unei soluții diluate de acid clorhidric distilă vapori mai săraci în acid decât soluția, până când concentrația acesteia crește, iar la 110°C distilă un acid clorhidric de compoziție constantă 20,2%. Asemenea soluții cu punct de fierbere constant se numesc amestecuri azeotrope.
Acidul clorhidric gazos este un compus foarte stabil (se descompune la o temperatură de peste 1800°C). Activitatea lui ca acid este aproape inexistentă; numai la temperaturi înalte poate ataca unele metale. În prezență de urme de apă, el reacționează cu amoniacul și formează clorura de amoniu:
NH3 + HCl → NH4Cl
Astfel, dacă se apropie de două vase, unul cu o soluție concentrată de amoniac și celălalt cu o soluție concentrată de acid clorhidric, se observă formarea unui fum alb: sunt particule de clorură de amoniu.
Soluția de acid clorhidric în apă este un acid tare, proprietate pe care nu o prezintă acidul clorhidric gazos; prin electroliza ei se descompune, în hidrogen și clor (pe când acidul clorhidric, în stare gazoasă sau lichefiat nu este un electrolit). Cu metalele formează cloruri.
Metalele situate înaintea hidrogenului în seria tensiunilor electrochimice înlocuiesc hidrogenul din acidul clorhidric; la unele metale reacția are loc la temperatura obișnuită, de exemplu în cazul zincului:
Zn + 2HCl → ZnCl2 + H2
La alte metale este necesar un aport de căldură. Cuprul reacționează la rece cu acidul clorhidric numai în prezența oxigenului:
2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
Aurul și platina nu reacționează cu acidul clorhidric. Deoarece acidul clorhidric în soluție reacționează ușor cu metalele uzuale (Fe, Al, Ni, Sn), el nu poate fi manipulat în vase metalice.
Acidul clorhidric reacționează cu oxizii de metale și cu bazele, formând o clorură și apă:
ZnO + 2HCl → ZnCl2 + H2O
NaOH + HCl → NaCl + H2O
De asemenea, reacționează și cu diferite săruri, formând cloruri. Astfel, cu azotatul de argint, AgNO3, se obține clorură de argint, un precipitat alb, cu aspect brânzos, care este insolubil în acid azotic:
AgNO3 + HCl → AgCl + HNO3
Reacția fiind caracteristică folosește la identificarea ionului Cl-.
Similar, este caracteristică reacția dintre acidul clorhidric și carbonatul de calciu; se produce o efervescență datorită degajării bioxidului de carbon rezultat prin descompunerea acidului carbonic, care este un compus foarte instabil:
CaCO3 + 2HCl → CaCl2 + H2CO3; H2CO3 → H2O + CO2
Acidul clorhidric este unul dintre cei mai folosiți atât în industrie, cât și în laborator. Astfel, el este consumat în cantități mari pentru fabricarea diferitelor cloruri anorganice (de exemplu, clorură de amoniu, de fier, de staniu, de zinc, de cupru, etc) și a unor produse organice importante ca: anilina, diferiți coloranți, clorura de vinil (materie primă pentru fabricarea unor materiale plastice), clorura de etil (anestezic cunoscut sub numele de “kelen”), apoi la extragerea gelatinei din oase (acidul clorhidric atacă materia osoasă și astfel rămâne gelatina), la prepararea cărbunelui activ, a pământului decolorant, la tăbăcirea și vopsirea pieilor, la colorarea țesăturilor textile, etc.
În metalurgie, acidul clorhidric este folosit pentru decapajul (curățirea) foilor de tablă de oțel care urmează să fie galvanizate. Împreună cu zinc se folosește (sub numele de apă tare) pentru lipit metale.
În laborator, acidul clorhidric se întrebuințează la prepararea clorului, hidrogenului, hidrogenului sulfurat, bioxidului de sulf, etc.
Clorurile (sărurile acidului clorhidric) sunt substanțe solide cristalizate și, în general, solubile în apă. Insolubile sunt clorurile de argint, de mercur, de cupru; foarte puțin solubilă este clorura de plumb.
Cele mai importante cloruri sunt:
 NaHSO4 + HCl
NaHSO4 + HCl
 NaHSO4 + HCl
NaHSO4 + HCl Na2SO4 + HCl
Na2SO4 + HCl 2HCl + Na2SO4
2HCl + Na2SO4 2HCl
2HCl