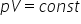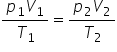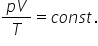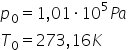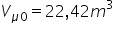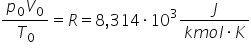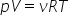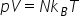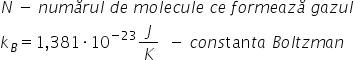Procese izoterme. Ecuaţia Clapeyron-Mendeleev.
Tag-uri
Partajeaza in Google Classroom

Transcript
începe 5-a Lecții de termodinamică
vom discuta despre procese izoterme
care sunt descrise prin legea Boyle
mariotte și despre ecuație generală
a gazelor numită și ecuația clapeyron
mendele studiem experimental procesul
izoterm folosind următorul dispozitiv
avem o curvă care este plină cu
apă și izolată termic Deci cumva
este izolată termic ceea ce înseamnă
că întreg procesul are loc la temperatură
constantă în motiv pentru care
se numește procese zotea verifică
temperatura este constantă de lungul
experimentului Folosind un termometru
ce măsoară temperatura în interiorul
cuvei se află un balon în care
se află gazul pe care o studiem
de ce aici este gazul balonul se
continuă cu un tub de sticlă în
formă de untul vertical și conține
o coloană de mercur diferența de
nivel dintre nivelul melcului din
ramura Stângă și nivelul melcului
din ramura dreaptă generează o
diferență de presiune acest lucru
Ați învățat în clasa a opta diferența
de presiune generată de o coloană
de lichid este egală cu densitatea
lichidului înmulțită cu accelerația
gravitațională înmulțită cu înălțimea
coloanei de lichid Salut prin care
Vama ceastă presiune este următorul
baza tubului sub formă de u De
ce această regiune este din cauciuc
motiv și din acest motiv putem
ridica sau coborî ramura dreaptă
a tubului și în acest fel varia
această denivelare între cele două
coloane din mercur din stânga și
din dreapta tubului și în felul
acesta Variant presiunea măsurăm
presiunea ca funcție de volum și
mod experimental obținem legea
Boyle mariotte care sunt boieri
walk care spune că produsul dintre
presiune și volum în un proces
izoterm este constant formulare
ar fi pentru o masă de gaz constantă
aflată la temperatură constantă
volumul variază invers proporțional
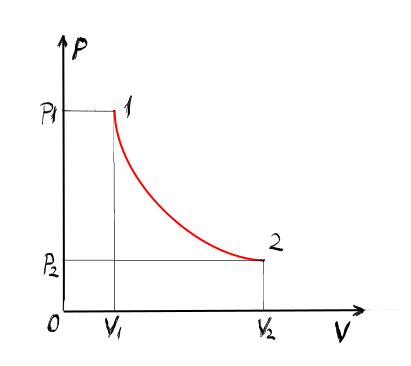
cu presiune dacă Reprezentăm grafic
pentru o diagramă de stare la peron
și anume o diagramă presiune volum
vedem că acest tip de proces corespunde
și anume procesul izoterm corespunde
unei hiperbole asta înseamnă că
între o diagramă presiune volum
ele vor arăta de sol acesta o hiperbolă
Care este un arc separat emoții
metric de bisectoarea cadranului
Deci dacă desenăm această dreaptă
ce foloseste si are un unghi de
45 de grade hiperbolă simetrică
față de această dreaptă iar aceste
izoterme ce corespunde săriturilor
temperaturi constante se îndepărtează
de originea diagramei pentru o
temperatură crescătoare Deci dacă
reprezentare prezinți hiperbola
pentru o temperatură de 2 mai mare
decât unul Ia va fi mai depărtată
de Orange dacă am izoterma pentru
altă temperatură te 3 care este
mai mare decât al 2-lea va fi și
mai depărtată de originea o diagramă
sa ducem acum ecuația generală
a gazelor aceasta este ecuația
pentru un proces în care singurul
parametru păstrat constant este
masa gazului și să încercăm să
stabilim ecuația pentru un proces
ce pleacă din starea de echilibru
echilibrul 1 cu parametrii de stare
pe 1 v-1 t16 jungi în starea finală
de echilibru 2 cu parametri pe
2.2.2 trasăm diagrama TV clapeyron
Deci presiune volum presiunea măsurată
în Pascali volumul metri cubi și
plecăm dintru anumit punct 1 și
Încercăm să ajungem în turnare
mic.de punctul 1 având volumul
V1 și presiunea pe 1 punctul 2
în mod Evident având presiunea
pe 2 și volumul V2 cele două puncte
se vor afla pe doi so termin diferite
corespunzând celor două temperaturi
punctul 1 pe orizontal mă de temperatură
constantă de 1 punctul 2 pe o izotermă
de temperatură constantă T2 observăm
că putem ajunge de la Starea 1
la Starea 2 în această de g pe
diferite drumuri un prin drum ar
fi cel care pleacă din punctul
1 dar lungul izotermei de 1 până
în punctul a Deci avem 1 acest
proces izoterm de la 1 la am în
care temperatură constantă urmat
de procesul de la ala 2 care este
un proces izobar presiunea este
constant egală cu p2 pentru aceste
procese putem scrie pe 1 V1 este
egal cu p 2 va Deci acesta este
ecuația procesului is atent a 1
pe 1 v-1 este egal cu 2ba unde
va este volumul în starea ei am
iar pentru procesul izobar pe 2
egal constant putem scrie va împărțit
la d 1 este egal cu V2 împărțit
la T2 eliminând volumul va din
aceste Două ecuații obține încă
pe 1 v-1 împărțit la T1 este egal
cu p 2 v-2 împărțit la T2 putem
de asemeni să ajungem din punctul
1 în punctul 2 plecând întâi cu
o izobară în care presiunea este
constantă și egal cu pe unul de
la punctul 1 la punctul b și apoi
continuând cu o izotermă de la
punctul B la punctul 2 în care
temperatură constantă și egală
cu T2 scriind ecuațiile pentru
aceste două procese avem că Z1
împărțit la T1 egal cu vb împărțit
la de 2 aceasta este ecuația pentru
izobara de la A1 la b între 1 și
b și pentru izoterma de 2 egal
constant de la Bella 2 avem că
pe 1 Z b este egal cu p 2 v-2 eliminând
volumul în punctul b din aceste
Două ecuații obținem ecuație identică
pe 1 v-1 împărțit la T1 este egal
cu p 2 v-2 împărțit la T2 Deci
indiferent de drumul la ales ce
pleacă procesul ales ce pleacă
din starea unu către starea 2 obținem
ecuația generală că produsul dintre
presiune și volumul împărțită la
temperatura absolută este o constantă
dorim acum să aflăm valoarea acestei
constante și plecăm de la următoarea
Definiți volumul molar normal este
volumul ocupat de 1 KW de gaz oricare
gaz în condiții normale Adica la
presiunea atmosferică Care este
aproximativ egală cu 10 la puterea
a cincea Pascal și temperatura
de 273 grade Kelly acest în aceste
condiții putem măsura volumul unui
kg de gaz și obținem această valoare
pentru volumul molar normal 22 sute
14 m cubi kilomol de asemeni știind
că volumul total al gazului este
egal cu produsul dintre numărul
de kilomoli și volumul unui kilomoli
adică acest volum molar normal
deoarece ecuația generală a gazelor
este pentru mase constante Asta
înseamnă cantitatea de substanță
este egală Deci museros numărul
de kilometri între o stare 0 este
egal cu numărul de kilometri în
orice altă stare de ce nu 0 egal
cu 1 și 2 și b 0 este egal cu 1
ori 0 în concluzie putem scrie
că pe V împărțit la c este egal
cu 0 0 împărțit la 0 unde TV și
teste sunt parametrii de stare
a unei stări ori cale iar p0070
sunt parametrii de stare Are acestei
stări de cont în condiții normale
acest acest produs ultima de la
port poate fi scris ca nu înmulțit
cu 0 0 m 0 volumul alar în condiții
normale împărțit la 0 dând p0rm
0 împărțit la 0 care Evident este
o constantă cu e cu r obține încă
TV este egal cu un aer înmulțit
cu temperatura absolut Unde este
constanta Myers sau constant universală
a gazelor și poate fi calculată
imediat pentru că știm atât pe
030 cât și 0 și obținem această
valoare o formă alternativă foarte
folosită și am practică a ecuației
general a gazului Înlocuiește numărul
de kilomoli cu numărul de atomi
sau molecule plecând de la următoarele
luați numărul de atomi sau molecule
din gaz va fi egal cu numarul de
kilomoli înmulțit cu numărul lui
avogadro asta este chiar definiția
numărului avocatul este numărul
de atomi sau molecule kilomol și
în consecință putem scrie că nu
este egal cu n împărțit la n a
numărul de molecule sau atomi împărțit
la numărul avocado pe care înlocuind
în prima formulă această formulă
obținem că TV este egal cu n înmulțit
cu raportul dintre a și n a care
se mai numește și Constanța boltzmann
Deci privește n Constanța boltzmann
temperatura de Constanța boltzmann
este raportul dintre Constanta
mire și numărul la avocat ruși
are această valoare să continuăm
cu un exemplu simplu dorim să calculăm
Care este procentul de masă de
aer pierdut de anvelopa unei biciclete
care este înțepată dacă volumul
anvelopei scade cu 5% și presiunea
cu 15% Deci avem o bicicletă care
merge pe ouă șosea la un moment
dat se încep am anvelopa anvelopa
se înțeapă și știm că pierdem un
volum avem o pierdere de volum
de 5% de ceea ce Asta este pierderea
în volum și o pierdere în presiune
de 15% Deci pierderea de presiune
și am vrea să știm Care este pierderea
de masa relativă adică Delta m
supra m 1 unde m 1 este masa inițială
în condițiile în care Considerăm
temperatura constantă Deci scrie
ecuația gazului din anvelopă înainte
de în separe De ce avem pe 1 V1
este egal cu unu unu RT care poate
fi scrisă ca m-1 împărțit la masa
molară Deci numărul de moli este
masa totală împărțită la masa unui
Mall rt și la fel scrie mă aceeași
ecuație pentru situația de după
la sfârșitul acestui proces deci
pe 2 V2 este egal cu 2 r t și egal
cu masa totală împărțită la masa
unui Mall al gazului împărțit la
r t de aici putem calcula că Delta
m împărțit la M1 care prin definiție
este M1 minus se îndoi împărțit
la M1 va fi egal cu pe 1 V1 minus
pe 2 v-2 împărțit la pe 1 V1 adică
este egal cu 1 minus pe 2 împărțit
la pe unul înmulțit cu 2 împărțit
la v-1 aceasta este ecuația pentru
procentul de masă de gaz pierdut
înlocuind valorile obținem 1 minus
0 înmulțit cu 0 ceea ce înseamnă
că avem o pierdere de masă de 19
și 5% în anvelopa Caut un comentariu
și exemplu acestor acestor ecuații
generală a gazelor este foarte
utilă în multe procese ca Spre
exemplu conducerea și manipulare
a unui balon cu aer cald știind
că atât presiune atmosferică cât
și temperatura atmosferă scade
odată cu creșterea altitudinii
motiv pentru care Forța de tracțiune
verticală a gazului scade din acest
motiv folosim o lampă cu propun
pentru a încălzi aerul Da crește
temperatura internă a balonului
o aplicație importantă practică
importantă este cea a baloanelor
meteorologice care trebuie să aibă
o altitudine stabilă la altitudini
mari undeva între 25 și 40 de km
pentru un timp îndelungat timp
de luni de zile pentru a putea
face măsurători meteorologice la
înălțime constant Deci trebuie
să avem un control foarte bun asupra
tuturor parametrilor de stare ale
gazului din interiorul balonului