Hidroliza sărurilor
Tag-uri
Partajeaza in Google Classroom
Teorie: Hidroliza sărurilor Descarcă PDF
Sărurile sunt compuși ionici care se formează, în general, prin neutralizarea dintre un acid și o bază. Sărurile solubile disociază în apă în ionii lor componenți.
Sărurile sunt toate formate din câte un cation (ion pozitiv) provenit de la o bază, si un anion (ion negativ radical acid) provenit de la un acid.
Deoarece apa are caracter amfoter, sunt posibile reacții cu schimb de protoni între unii dintre ionii din structura sărurilor și moleculele de apă.
Atunci când o sare se dizolvă în apă, soluția apoasă de sare care se obține poate fi neutră, acidă sau bazică, în funcție de natura ionilor componenți ai sării respective.
Reacția de hidroliză este reacția cu schimb de protoni dintre moleculele de apă și ionii proveniți dintr-o sare, care are loc la dizolvarea unor săruri în apă.
După comportamentul la hidroliză, putem clasifica sărurile astfel:
- Săruri care formează soluții neutre (săruri provenite de la acizi tari și baze tari);
- Săruri care formează soluții acide (săruri provenite de la un acid tare și o bază slabă);
- Săruri care formează soluții bazice (săruri provenite de la un acid slab și o bază tare);
- Săruri provenite de la acizi slabi și baze slabe – aceste săruri pot forma soluții neutre, acide sau bazice.
1. Săruri care formează soluții neutre:
Acestea sunt sărurile care au anionul unui acid tare și cationul unei baze tari. Soluțiile formate la dizolvarea în apă a acestor săruri sunt neutre deoarece anionul și cationul din componența sărurilor nu reacționează cu apa.
Exemplu – Dizolvarea azotatului de sodiu (NaNO3) în apă:
Cationul provine de la NaOH, care este o bază tare, iar anionul provine de la HNO3, care este un acid tare:
HNO3 + NaOH → NaNO3 + H2O
HNO3 (l) + H2O(l) → NO3- (aq) + H3O+(aq)
Ionul azotat este baza conjugată a acidului azotic, și este o bază mai slabă decât apa. Nu va reacționa cu ionul hidroniu pentru a reforma acidul azotic. Anionul unui acid tare este hidratat la dizolvare însă nu reacționează în niciun fel cu apa sau cu ionii hidroniu din soluție.
NaOH(s) (dizolvare în apă) → Na+(aq) + HO-(aq)
Ionul Na+ intră în soluție sub formă hidratată, însă nu reacționează în niciun fel cu apa sau cu ionii hidroxil din soluție pentru a reforma baza. Cationii tuturor bazelor tari se comportă în acest fel în soluții apoase.
Astfel, soluția apoasă de azotat de sodiu este neutră, deoarece nu are loc niciun transfer de protoni între apă și ionii componenți ai sării.
Anionii acizilor tari: Cl-, I-, Br-, ClO4-, SO4-, NO3-.
Cationii bazelor tari: Li+, Na+, K+, Rb+, Cs+, Fr+, Ca2+, Sr2+, Ba2+.
2. Sărurile care formează soluții acide:
Acestea sunt sărurile care conțin anionul unui acid tare și cationul unei baze slabe. Soluțiile formate la dizolvarea unor astfel de săruri în apă au caracter acid deoarece cationul se comportă ca un acid slab în prezența apei, în timp ce anionul nu reacționează.
Exemplu – Hidroliza clorurii de amoniu (NH4Cl):
Clorura de amoniu este formată din ionul clorură, provenit de la un acid tare (HCl), și ionul amoniu, provenit de la o bază slabă (NH3).
NH4+ (aq) + H2O(l) 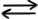 NH3 (aq) + H3O+(aq)
NH3 (aq) + H3O+(aq)
Ionul amoniu este un acid slab care reacționează cu apa formând un ion hidroniu.
Așadar, la dizolvarea în apă a clorurii de amoniu, ionul clorură nu reacționează, în timp ce ionul amoniu contribuie la mărirea concentrației de ioni hidroniu, dând astfel soluției un caracter acid.
3. Sărurile care formează soluții bazice:
Acestea sunt sărurile care conțin anionul unui acid slab și cationul unei baze tari. Soluțiile formate la dizolvarea unor astfel de săruri în apă au caracter bazic deoarece anionul se comportă ca o bază slabă în prezența apei, în timp ce cationul nu reacționează.
Exemplu – Hidroliza sulfurii acide de sodiu (NaHS):
Sulfura acidă de sodiu este formată din ionul Na+ , provenit de la NaOH, care nu reacționează cu apa, și din ionul sulfură acidă, HS-, provenit de la acidul sulfhidric (H2S).
HS- (aq) + H2O(l) 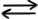 H2S (aq) + HO-(aq)
H2S (aq) + HO-(aq)
Ionul sulfură acidă se comportă ca o bază slabă: acceptă un proton de la o moleculă de apă, lăsând astfel în urmă un ion hidroxil.
Așadar, la dizolvarea în apă a sulfurii acide de sodiu, ionul Na+ nu reacționează, în timp ce ionul sulfură acidă contribuie la mărirea concentrației de ioni hidroxil, dând astfel soluției un caracter bazic.






