Legătura ionică. Compuşii ionici.
Partajeaza in Google Classroom
Teorie: Teorie - Legătura ionică și compușii ionici Descarcă PDF
Legătura ionică și compușii ionici
Starea de energie minimă reprezintă tendința atomilor de a depune cât mai puțin efort sau energie pentru a exista într-o stare cât mai stabilă. Acest lucru se poate îndeplini prin realizarea unor structuri electronice stabile pe ultimul strat, structuri corespunzătoare celui mai apropiat gaz inert din tabelul periodic.
Gazele inerte au configurații electronice de octet (8 e- în ultimul strat electronic), cu excepția heliului care are configurație de dublet (2 e- în ultimul strat electronic). Aceste configurații oferă inerția chimică a acestor gaze. Atomii tuturor elementelor tind spre această inerție.
Regula octetului prevede că, de cele mai multe ori, atomii tind să-și realizeze o configurație electronică stabilă de 8 e- pe ultimul strat.
Atomii elementelor pot ajunge la configurații stabile prin 3 modalități care duc la formarea legăturilor chimice cu alți atomi:
- cedare de e-,
- primire de e-,
- punere în comun de e-.
Legătura chimică este o interacție de lungă durată între atomi care le permite acestora să formeze compuși chimici. Tipul legăturii chimice depinde de modul de formare: dacă legătura rezultă din forțele de atracție electrostatică între atomi cu sarcini opuse, sau dacă rezultă prin punerea în comun de electroni.
Legătura covalentă presupune punere în comun de electroni între atomi.
Legătura metalică presupune punere în comun de electroni între atomi ai metalelor în stare elementală.
Legătura ionică presupune un transfer de electroni de la un atom la altul: un atom cedează electroni, iar celălalt atom acceptă electroni. Astfel se formează ioni cu sarcini electrice opuse între care se manifestă forțe de atracție electrostatică. Transferul de ioni are loc de la un element cu caracter metalic, către un element cu caracter nemetalic.
Simbolurile Lewis sunt diagrame energetice simplificate care reprezintă numai electronii din nivelul electronic exterior, cel mai îndepăratat de nucleu. Simbolurile Lewis nu afișează electronii din nivelurile energetice complete, care nu contribuie la proprietățile chimice ale speciei respective.
Reprezentarea formării unei legături ionice prin simboluri Lewis:
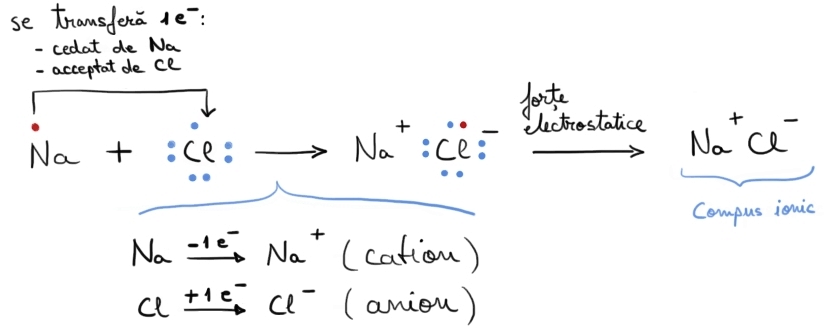
Legătura ionică ia naștere prin atracția electrostatică dintre sarcinile electrice opuse ale unui cation (de obicei metalic) și unui anion (de obicei nemetalic).
Compușii ionici sunt compuși chimici formați din ioni ținuți împreună prin legături ionice, legături care sunt, de fapt, forțe de atracție electrostatică între sarcina pozitivă a cationului component și sarcina negativă a anionului. Per total, sarcina electrică a unui compus ionic este neutră.
Compușii ionici sunt substanțe cristaline – ionii ocupă poziții fixe într-un ansamblu geometric regulat numit rețea ionică.
Legătura ionică nu este o legătură propriu-zisă, ea nu are orientare în spațiu. Așadar, prin legături ionice nu se pot forma molecule. Forțele de atracție electrostatică acționează în toate direcțiile formând rețele cristaline pe care le recunoaștem drept compuși ionici.
Compușii ionici pot fi:
- săruri (NaCl, CuSO4, AgF, etc.);
- oxizi bazici (Na2O, CaO, etc.);
- hidroxizi (NaOH, Mg(OH)2,etc. ).
Caracteristici generale ale compușilor ionici:
- sunt substanțe solide;
- formează cristale;
- au puncte de topire și de fierbere foarte ridicate;
- cei solubili în apă formează soluții care conduc curentul electric.






