Proteinele
Tag-uri
Partajeaza in Google Classroom
Teorie: Proteine Descarcă PDF
Proteinele şi peptidele sunt polimeri ai aminoacizilor proveniţi în urma unor reacţii de policondensare. Unităţile care se repetă se numesc resturi de aminoacizi.
- o dipeptidă conţine 2 resturi de aminoacizi;
- o tripepeptidă conţine 3 resturi de aminoacizi;
- oligopeptidele conţin între 3 şi 10 resturi de aminoacizi;
- polipeptidele conţin mai mult de 10 resturi de aminoacizi.
Aminoacizii sunt compuşi organici polifuncţionali care conţin în moleculă atât grupe amino (– NH2), cât şi grupe carboxil (– COOH). Aceste grupe funcţionale sunt legate de un radical hidrocarbonat, care poate avea structură diferită.
Atunci când un aminoacid are mai mult de 3 atomi de carbon în moleculă, se precizează în denumire poziţia grupei amino pe catena acidului carboxilic. De obicei, numerotarea se face cu litere din alfabetul grecesc pornind de la atomul vecin grupării carboxil.
În imaginea de mai jos este reprezentat un α–aminoacid:
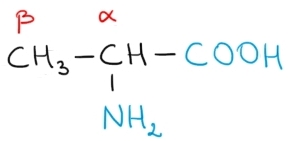
Proteinele din organismele vii sunt formate numai din α – aminoacizi.
Reacţia de policondensare a aminoacizilor: prin eliminarea unei molecule de apă între grupa amino a unui α–aminoacid şi grupa carboxil a altui α–aminoacid, se stabileşte o legătură numită legătură peptidică. Aminoacizii participanţi la condensare pot fi identici sau diferiţi.
În imaginea de mai jos este reprezentat produsul unei reacţii de policondensare între doi aminoacizi – o dipeptidă, şi este evidenţiată legătura peptidică. Radicalii hidrocarbonaţi sunt notaţi generic cu R:
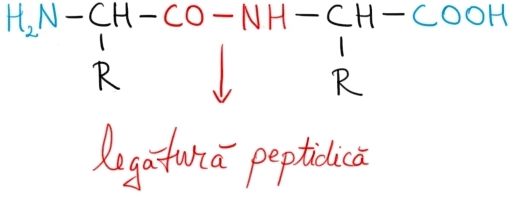
Proteinele sunt polipeptide naturale formate prin policondensarea a 40 până la câteva mii de resturi de aminoacizi.
Funcţiile proteinelor şi peptidelor în sistemele biologice:
- protecţie faţă de mediul exterior (keratina);
- oferă structură (colagenul);
- protecţie faţă de microorganisme invazive (anticorpii);
- biocataliză (enzimele);
- funcţie de transport (hemoglobina), etc.
În proteinele din organismele vii se întâlnesc 20 de α–aminoacizi diferiţi. Dintre aceştia, 10 sunt aminoacizi esenţiali.
Aminoacizii esenţiali sunt aminoacizii pe care organismul uman nu-i poate sintetiza deloc, sau nu-i poate sintetiza în cantităţi suficiente. Aşadar, aceştia trebuie să facă parte din dietă. Un adult are nevoie de 70-80 grame de proteine zilnic.
În funcţie de solubilitate, proteinele se clasifică astfel:
- Proteine insolubile: acestea se mai numesc şi scleroproteine şi se întâlnesc în organismele animale în stare solidă. Scleroproteinele oferă organelor rezistenţă mecanică sau protecţie împotriva agenţilor exteriori. Aceste proteine nu pot fi hidrolizate şi, de aceea, nu au valoare nutritivă. Exemple: keratina, colagenul.
- Proteine solubile: se întâlnesc în celule, în stare dizolvată sau sub formă de geluri hidratate. Marea majoritate a proteinelor solubile au funcţii fiziologice importante. Exemple: hemoglobina, albumina.
În funcţie de compoziţie, proteinele se clasifică astfel:
- Proteine simple: acestea sunt proteine care la hidroliză, formează numai aminoacizi.
- Proteine conjugate sau proteide: acestea sunt proteine care la hidroliză formează şi alţi compuşi pe lângă aminoacizi. Proteinele conjugate sunt formate dintr-o componentă proteică, şi o componentă prostetică. Partea prostetică poate fi formată din molecule precum resturi de zaharide (glicoproteide), de grăsimi (lipoproteide), acid fosforic (fosfoproteide), sau chiar ioni metalici (metaloproteide).
Denaturarea proteinelor este procesul fizico-chimic prin care se distruge structura proteinei şi se pierde funcţia ei fiziologică.
Factori denaturanţi chimici: acizii şi bazele tari, sărurile metalelor tranziţionale, solvenţii organici sau detergenţii.
Factori denaturanţi fizici: căldura, radiaţiile radioactive, ultrasunetele.






