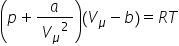Izotermele Andrews. Topirea. Diagrama de fază. Punctul triplu.
Tag-uri
Partajeaza in Google Classroom

Transcript
încet de 15 a lecției de termodinamică
vom continua discuția despre transformările
stărilor de agregare în particular
vom discuta despre lichefiere și
topire începem cu așa numitele
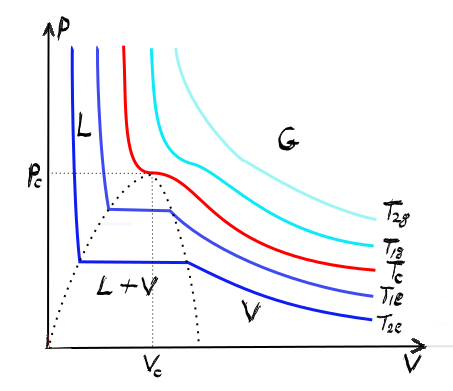
izotermei and izotermele andrews
sunt izotermele obținute experimental
de către n Andreas în studiul anumitor
gaze reale în particular ce vedem
în această imagine sunt izotermele
dioxidului de carbon De ce acest
grafic prezintă în coordonate clapeyron
presiune volume izotermele adică
curbele la temperatură constantă
izotermă înseamnă temperatură constantă
ale stărilor prin care trece gazul
de de oxid de carbon Ce ce putem
observa ca proprietăți principale
ale acestui Ce pot Ce reies din
acest grafic este în primul rând
comportarea la temperatură mare
Deci aceste izoterme precum cea
pentru 50 de grade Celsius au dependența
sau forma tipică celor pentru gazul
ideal am văzut că izoterma unui
gaz ideal în coordonate PV presiune
volum este o hiperbolă și întradevăr
cu culoare verde pentru 50 de grade
Celsius vedem o izotermă ce are
o forma foarte apropiată unei hiperbole
Pe măsură ce scădem temperatura
izotermei Spre exemplu cu această
culoare maro la femme izotermă
la 40 de grade Celsius observând
că apar deformări care cresc Pe
măsură ce temperatura scade la
extremă spre 0 grade Celsius izotermele
au trei componente clare o componentă
la volum mic care un palier vertical
apoi o componentă la volum intermediare
care e are forma unui poligon și
final la volum mari și presiune
mici și presiuni mici recuperăm
această dependență hiperbolică
tipică gazului ideal Deci eu prima
concluzia ar știi că gazul real
în particular în acest caz gazul
de jos de carbon are dependența
sau caracteristicile tipice gazului
ideal în două ori Jimmy primul
regim este cel de temperaturi mari
în acest caz de oxid de carbon
peste 50 de grade Celsius cel de
al doilea regim este cel la presiuni
mici și volum mare de chin această
zonă în care vedem că obținem dependență
hiperbolică a izotermelor observăm
de asemeni că există un punct foarte
important în acest grafic numit
punctul critic la notat cu p c
și are unul am pus o un punct mare
roșu El este foarte important pentru
că arată punctul de tranziție dintre
zona în care gazul se transformă
direct în lichid Deci această zonă
de Sus în care avem o tranziție
gaz direct închid solid lichid
direct în gaz Deci punctul critic
separă această zonă de zona inferioară
în care tranziția dintre starea
lichidă și starea gazoasă are loc
printre o stare intermediară compusă
atât din lichid cât și vaporul
Deci un amestec lichid vapori dacă
e să ne uităm mai atent la această
zonă putem observa că gazul a reluare
unui om creștere a volumului acompaniată
de creșterea presiunii palierul
a b c în mezotermal pentru 20 de
grade Celsius apoi la un moment
dat și anume punctul c în graficul
nostru intrăm un regim cu totul
nou în care variația de volum are
loc fără variație de presiune segmentul
CD în care sistemul trece din stare
gazoasă întruna de amestec lichid
vapori și în film în final la un
moment dat și anume punctul E pe
această izotermă de 20 de grade
Celsius comportare se schimbă radical
din nou și anume palierul orizontal
devin un parior vertical Care este
tipic stării lichide de ce observăm
că avem o variație foarte mare
a presiunii de la 60 de ani mă
sferă la 140 de armă sfere Care
este acompaniată de o variație
foarte mică insignifiantă a volumului
aceasta se datorează faptului că
lichidul este incompresibil aproape
oricâtă presiunea în pune pe un
lichid el nu se contractă bineînțeles
există valori limite dar exceptând
regimul presiunilor foarte foarte
mari lichidele sunt incompresibile
Deci zona de stare lichidă în acest
grafic corespunde cu această zona
hașurată de mine acum izoterma
care trece prin punctul critic
se numește izoterma critică pentru
deosebit de carbon ia corespunde
temperaturii de 31 de grade Celsius
și este foarte importantă pentru
că se pară aceste două regiuni
de două regiuni cu două tipuri
diferite de transformări din gaz
în lichid aceste rezultate experimentale
obținute de către andreus au fost
descrise ulterior de către van
der waals prin ecuația și anumită
ecuația gazului Real Dacă țineți
minte ecuația gazului de la ideale
rup f egal cu n r t această ecuație
Generală de stare a gazului ideal
în cazul reale ecuația arată în
felul acesta în care este raportul
dintre volum și numărul de moli
și se numește volumul molar iar
constantele a și b sunt două constante
ale substanței respective a conține
o informație complexă despre interacțiune
dintre molecule și b este așa numitul
cavalu moleculară să trecem la
topire și solidificare topirea
este bineînțeles trecerea substanței
din faza solidă în faza lichida
Ea este deschisă doar următoarele
legi prima lege spune că solidele
cristaline Se topesc la o temperatură
caracteristică fixă de ce avem
o valoare precisă a temperaturii
la care solidele cristaline se
topesc Pe de altă parte solidele
amorfe adică fără o structură moleculară
foarte bine precizată Se topesc
întruna anumit interval de temperatură
nu au o valoare temperaturii si
un interval de temperatură în care
are loc această transformare de
stare de agregare a doua lege spune
că temperatura de topire bineînțeles
pentru un solist cristalin pentru
că în cazul solidului cristalin
putem vorbi de o temperaturile
de topire Deci în acest caz ia
depinde doar de presiunea externa
foarte similar cu pentru solidul
cristalin legile sunt foarte similare
cu cele ale vaporizarii sau fierbe
în particular putem fi mai specifici
în cazul solidului cristalin și
anume putem spune că dacă volumul
crește în timpul topirii atunci
temperatura crește cu presiunea
și invers dacă volumul scade atunci
temperatura scade cu presiunea
Haideți Să arătăm grafic Ce înseamnă
aceste această ultimă lege Deci
Să considerăm diagrama volum temperatură
a în cazul topirii și ce ce vom
vedea este tranziția de stare de
agregare sau transformare de stare
de agregare pe care am deschis
uși și în lecția precedent și anume
că o dată cu creșterea temperaturii
avem următoarele regim regimuri
un Prime regim este cel în care
volumul se vadă la dilata la un
moment dat Deși volumul conțin
substanța continuă să se dă la
de la te duci volumul să cred să
crească nu mai avem o variație
de temperatură și în sfârșit întruna
a treia regiune recuperăm această
creșterea volumului însoțită de
creșterea temperaturii bineînțeles
Puteți identifica aceste regiuni
ca fiind cele în care căldura produce
o variație de temperatură apoi
transformarea de fază în care căldura
are loc fără variație de temperatură
și din nou o după transformat de
fază o regiune în care căldura
produce din nou o variație temperatură
mergând acum intru întruna alt
set de coordonate Deci Analizând
tradiția de fază în coordonatele
presiune temperatură în loc de
volum temperatură obținem altă
caracteristică foarte importantă
și interesantă a transformări de
fază acest tip de diagramă se numește
diagramă de fază Deci presiune
temperatură de diagramă de fază
pentru că în ea se poate vedea
linia de separarea celor două faze
Deci aceasta din i sau curbă este
linia în care cele două faze în
acest caz solid și lichid în cazul
topirii se află în echilibru Deci
la stânga a vom avea solid la Pa
lichid și vedem că în cazul în
care volumul crește în transformarea
de stare de agregare Deci avem
o creștere a volumului atunci temperatura
crește cu presiune de ce odată
cu creșterea temperaturii presiunea
va crește pe această curbă cel
de al doilea caz pe care îl voi
explica mai rapid este cel opus
în care volumul scade la transformarea
stării de agregare Deci vedem În
diagrama volum temperatură este
o creșterea volumului cu temperatura
până la punctul la care începe
transformarea stării de agregare
dar apoi avem invers nu o creștere
a volumului în timpul transformării
dar o scădere a lui și apoi Revenim
la o creștere cu temperatura în
acest caz diagrama corespunzătoare
diagramă de fază presiune temperatură
va avea dependența opusă adică
odată cu creșterea presiunii Teodora
scade ultima lege a topirii este
identică cu cea a fierberii și
anume că această transformare de
stare de agregare ca orice transformare
de stare de agregare are loc cu
un schimb de căldură absorbție
în cazul acesta sau emisie în cedare
de căldură în alte transformări
dar întotdeauna există un schimb
de căldură care are loc la temperatură
constantă după cum am discutat
pentru fierbere în acest caz căldura
nu mai poate fi legată cu o variație
temperatură bineînțeles și cu un
parametru specific transformării
de stare pe care îl notăm culanta
Deci q va fi masa amorțită Cu căldura
latentă specifică de topire în
acest caz iarăși după cum am discutat
pentru fierbere tranzițiile de
stări de agregare sau de fază sunt
reversibile asta înseamnă că transformarea
inversă va avea aceeași căldura
latentă specifică în particular
transformarea inversă topirii este
solidificarea și Deci căldura latentă
specifică de solidificare va fi
egală cu cea de topire să discutăm
un pic mai mult acest această noțiune
de diagramă de fază și vom introduce
în acest context nu ține de puncte
Înainte de asta să dăm definiția
ultimului tip de transformare de
stare de agregare despre carnea
discutat și anume sublimarea sublimare
este transformarea din stare solidă
în stare gazoasă De ce am vorbit
transformările lichid gaz în lecția
precedentă în lecția aceasta am
vorbit despre solid lichid și mai
rămâne o ultimul un ultimul set
de transformări între solid și
gazos sublimarea fiind transformarea
din stare solidă în cea gazoasă
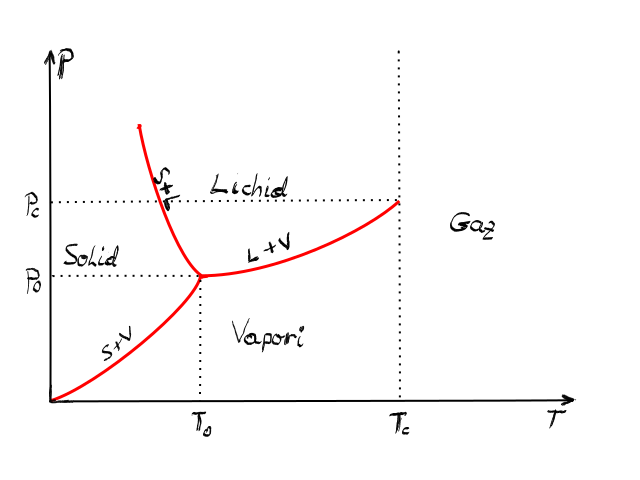
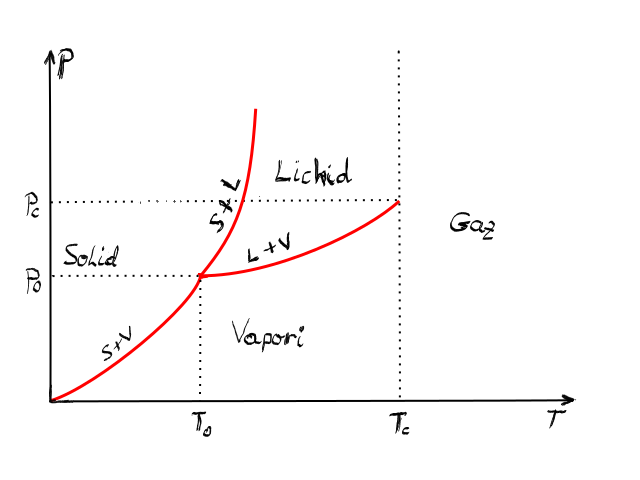
după cum am văzut se numește diagramă
de fază diagrama presiune temperatură
motivul pentru care este important
această diagramă este că în ea
apare acestei linii de echilibru
de fază între fazele substanțe
o diagramă tipică este arată în
felul următor de ciudă Grama de
fază va conține curbele de echilibru
între cele trei stări solid lichid
și gaz ale unei substanțe Deci
această curbă este curba solid
vapori decida lungul a în substanța
va fi in echilibru între stările
solid și vapori această curbă este
curba de echilibru solid lichid
și cea de a treia este curba de
echilibru lichid de fază bineînțeles
lichid vapori punctul de intersecție
ale celor trei curbe se numește
punctul triplu al substanței și
în el în acest punct substanța
se găsește simultan și în echilibru
în toate cele trei faze solidă
lichidă și gazoasă de asemenea
există un al doilea punct foarte
important o diagramă de fază și
anumit și așa și anume așa numitul
punct critic care corespunde temperaturii
critice temperatura critică fiind
temperatura la care o substanță
nu mai poate fi în stare lichidă
indiferent de presiune deci pur
și simplu am dat substanței atât
de multă energie cinetică la nivel
molecular încât stările de lichid
sau de vapori sau alte stări decât
cea legat nu mai pot exista și
indiferent de alte considerente
de genul presiune sau azi parametrii
Transformarea în starea gazoasă
are loc instantaneu aceasta este
temperatura critică fiecare substanță
are parametrii bine Definiți atât
pentru punctul triplu deci pe deși
temperatura țiplă cât și pentru
punctul critic De ce o substanță
va avea o valoarea presiunii critice
și temperaturii critice Spre exemplu
pentru apă avem acești parametri
pentru punctul triplu și punctul
critic a după cum se poate vedea
din aceste valori Spre exemplu
presiunea punctului triplu este
612 pas pe când pe când presiunea
punctului critic este 22 de megapascali
deci diferența dintre ele este
de 6 ori Dine de magnitudine mega
este 10 la 6 m de aici vedem că
diagrama care am trasaturi eu este
numai orientativă bineînțeles formele
acestor curbe depind variază mult
de la o substanță la alta am trasat
numai o diagramă schematică pentru
a exemplifica sau explica Ce înseamnă
aceste linii de echilibru și pe
aceste puncte triple și foarte
des întâlnim în natură toate trei
fazele unei substanțe Spre exemplu
această imagine frumoasă ne arată
o poză luate în timpul iernii a
cascadei Niagara observăm că avem
simultan toate cele trei fazele
apei gheață zăpadă de stările solid
apoi apă în stare lichidă și bineînțeles
și apă în stare de vapori dacă
ar fi vizibile vizibilă apa în
stare gazoasă se vedea și ea dar
gazele nu sunt vizibile De ce avem
în același moment pentru un sistem
termodinamic la stări de agregare
sau faze ale apei în acest caz