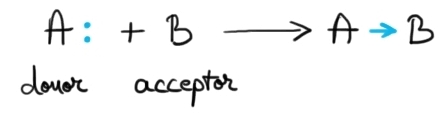Legătura coordinativă. Combinaţiile complexe.
Partajeaza in Google Classroom

Transcript
pe lângă legăturile covalente polare
și legăturile covalente nepolare
mai există un caz particular al
legăturii covalente și anume legătura
covalentă coordinativă după cum
știm deja legătura covalentă este
formată între doi atomi care împarte
o pereche de electroni Spre exemplu
în această moleculă de acid clorhidric
hidrogenul și clorul au pus în
comun fiecare câte un electron
pentru a forma legătura covalentă
atomii sunt ținuți împreună pentru
că perechea de electroni este atrasă
de nucleele ambilor atom de formare
a unei legături covalente simple
fiecare atom contribuie cu câte
un electroni Dar nu trebuie să
fie întotdeauna așa o legătură
coordinativă este o legătură covalentă
pentru că e vorba tot despre o
pereche de electroni împărțită
doar că în acest caz amândoi electronic
care formează legătura din de la
același atom pentru a înțelege
mai bine cum se formează aceste
legături vom lua ca exemplu o formare
a clorurii de amoniu amoniacul
și acidul clorhidric sunt două
gaze incolore dacă le amestecăm
se va forma un fum alb și dance
de clorură de amoniu în formă solidă
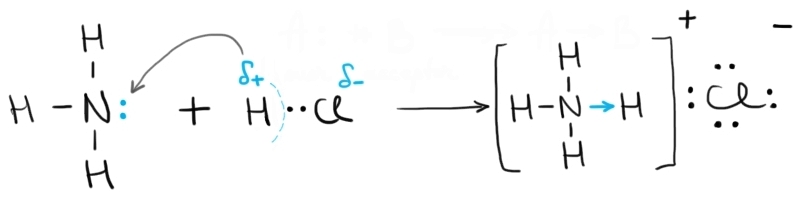
atomul de azot din molecula de
amoniac are cinci electroni în
stratul de valență Dintre aceștia
3 electroni pune în comun cu 3
electroni de la a trei atomi de
hidrogen azotul își formează astfel
configurație stabilă de octet iar
atomii de hidrogen își formează
configurații stabile de duble acestea
sunt Deci legături covalente polare
perechea de electroni ai atomului
de azot care nu participă la formarea
celor trei legături covalente polare
pereche de electroni neparticipanți
dar cu toate că atât azotul Cu
ce atomi de hidrogen au configurații
stabile amoniacul reacționează
totuși cu acidul clorhidric în
molecula de acid clorhidric atomul
de clor are electronegativitate
mare iar volumul atomului de clor
este mult mai mare decât cel al
atomului de hidrogen Deci molecula
de acid clorhidric este un dipol
asimetric iar electronii din legătura
covalentă sunt mai puternică atrași
de atomul de clor să notăm și sarcinile
parțiale ale celor doi atomi sarcini
o parțiale negativă pentru clor
și sarcina parțială pozitivă pentru
hidrogen în prezența amoniacului
atomul de hidrogen din acidul clorhidric
este atras puternic de atomul de
azot și se desprinde din acidul
clorhidric sub formă de Ion vidu
gen plus între atomul de azot care
are perechea de electroni neparticipanți
și ionul de hidrogen Care este
de fapt un Proton pentru că singurul
lui electron rămâne la clor care
are acum configurație de octet
deci între aceștia doi se stabilește
o legătură chimică la care numai
atomul de azot pune în comun electroni
se formează un Ion amoniu ionul
amoniu are sarcină pozitivă adusă
de Ionel hidrogen plus sarcină
pozitivă a protonului se distribuie
de cină interiorul ionului de amor
între atomul de azot și hidrogen
plus sau format o legătură covalentă
coordinativă pe care o Reprezentăm
cu săgeată Deci în acest Ion sunt
trei legături covalente simple
și o legătură covalentă coordinativă
care după ce se formează nu se
deosebește cu nimic de celelalte
trei legături ionul de amoniu interacționează
cu Ion clor minus rămas din molecula
de acid clorhidric după desprinderea
protonului și se formează un compus
ionic adică clorura de amoniu Așadar
legătura coordinativă se formează
între două specii chimice una care
are o pereche de electroni neparticipanți
Cum este atomul de azot în cazul
clorurii de amoniu și una care
are deficit de electroni Cum este
ionul hidrogeni plus pe cea care
aduce perechea de electroni se
numește Doner iar cea care primește
perechea de electroni se numește
acceptor legătura coordinativă
se reprezintă printre o săgeată
orientată de la Doner loc chapter
legătura coordinativă se întâlnește
și la formarea unei clase de combinații
chimice importante numite combinații
complexe combinațiile complex sunt
alcătuite dintre un Ion de metal
numit Ion central și molecule sau
Ion care poartă numele de liganzi
între ionul central și Liga se
vor stabili legături covalente
coordinative numărul de leagan
care sunt legați coordinativ de
Ionuț central se numește număr
de coordinare pot fi legați numai
moleculele și Ioni care conțin
cel puțin un atom cu o pereche
de electroni neparticipanți exemplu
pot fi leganes moleculele de apă
de amoniac sau de monoxid de carbon
sau moleculele organice mai pot
fi legați și Ion precum ionul clorură
ionul clorură hidroxil sau Ioni
fosfat și Sulfat Union de metal
poate fi Ion central numai dacă
are orbitali liberi în care pot
intra electronii puși în comun
de leagan să luăm Ca exemplu formarea
a hidroxidului de tetraaminocupru
2 aceasta fiind formula lui chimică
este un compus foarte mare poate
părea foarte complicat Dar de fapt
formarea acestui complex un proces
destul de simplu și logic mai întâi
trebuie să obținem hidroxid de
cupru prin reacția dintre sulfat
de cupru și hidroxid de sodiu de
reacție obține oxid de cupru și
sulfatul de sodiu hidroxidul de
cupru va reacționa în continuare
cu amoniac pentru obținerea a ionului
de tetralina cuplu dar mai întâi
Haideți să ne uităm mai îndeaproape
la ce se întâmplă cu electronii
în aceste reacții În primul rând
ne interesează configurația electronică
a atomului de cuprul are numărul
Atomic Z egal cu 29 și configurația
sa este aceasta configurația argonului
3D 10 4s pentru a înțelege mai
bine ce se întâmplă Haideți să
Reprezentăm orbitalii cu liniuțe
Deci configurația argonului și
cei cinci orbitali 3d orbitalii
3d sunt complet ocupați cu electroni
iar acesta este orbitalul 4s care
are un electron în molecula de
hidroxid de cupru cuprul are sarcina
2 plus de știa interesează configurația
electronică a ionului de cupru
2 plus ionul de cupru 2 plus are
cu doi electroni mai puțin decât
atomul de cupru de configurația
ionului este următoarea configurația
argonului cei cinci orbitali 3D
care de data aceasta conțin în
total nouă electroni aceasta este
orbitalul 4s însă pentru continuarea
reacției trebuie să luăm în calcul
și cei trei orbitali liber E ocupat
de electroni din structura ultimului
strat electronic al cuprului Deci
în total există patru orbitali
disponibile în ionul central cupru
2 plus pentru coordinare în prezența
a patru molecule de amoniac patru
atomi de azot pun în comun perechile
lor de electroni neparticipanți
cu ionul de cupru astfel încât
electroni se vor Oti atât în orbitalii
azotului cât și în orbitali libere
ai cuplului deci vrea aparține
atât azotului cât și cuplului calm
orice legătură covalentă deci între
atomi de azot din moleculele de
amoniac și ionul de cupru se stabilesc
patru legături covalente coordinative
astfel se formează ionul complex
de tetraaminocupru pentru a scoate
în evidență cele patru legături
coordinative putem reprezenta Ionel
de tetraaminocupru și în acest
an sarcina A2 plasa ionului complex
adusă de Ion de cupru 2 plus este
neutralizată de sarcina negativă
a 2 Ion de hidroxil din soluții
Deci ionul complex de tetraaminocupru
va fi neutralizat de doi ani hidroxil
iar produsul de reacție este hidroxidul
de tetraaminocupru 2 care este
un compus ionic solubil în apă
calculul sarcinii anului complex
se face foarte simplu luni în considerare
două cazuri în primul caz când
o legați de sunt molecule sarcina
ionului complex este pozitivă și
egală cu sarcina ionului central
este cazul ai anului de tetraaminocupru
despre care tocmai am vorbit am
spus că sarcina ionului de cupru
este 2 plus și astfel și sarcina
ionului complex este tot 2 plus
al doilea ca Azi când liganzii
sunt eu negativ sarcina ionului
complex se calculează făcând suma
sarcinilor ionilor din Complex
ținând seama de numărul de coordinare
de exemplu în cazul ionului de
hexafluorură de fier sarcina ionului
central este plus 3 iar sarcina
le gandului este minus 1 și pentru
că avem șase liganzi sarcina va
fi în minus șase astfel rezultă
că sarcină a complexului este plus
3 minus 6 egal cu minus 3 stau
în cazul ionului complex de tetrahidroxo
zincat zincul care este anul central
are sarcină 2 plus sarcina ligandul
lui hidroxil este minus 1 și pentru
că sunt patru legal în total va
fi minus 4 Deci sarcina ionului
complex va fi plus 2 minus 4 egal
cu minus doi sunt foarte multe
exemple de combinații complexe
acestea sunt în general intens
colorate iar cele mai frecvente
utilizări sunt în analiza chimică
o serie de Ion lor formează foarte
ușor combinație complexă a colorate
intense sau cu mobilitate redusă
prezentul Cunoscând aceste caracteristici
despre un metal cum că formează
o combinație complexă colorată
între un fel anume se poate determina
prezența acestui metal între o
soluție cu conținut necunoscut
bun până acum am vorbit despre
legăturile formate între atomii
elementelor lecția viitoare vom
vedea că și între molecule există
mai multe tipuri de interactii
Deci vom începe să vorbim despre
forțele intermoleculare