Acizi şi baze. Teoria protolitică.
Partajeaza in Google Classroom
Teorie: Teorie - Acizi şi baze. Teoria protolitică a acizilor şi bazelor. Descarcă PDF
Acizi şi baze. Teoria protolitică a acizilor şi bazelor.
Protonul este o particulă subatomică din nucleul atomilor. Însă în cazul atomului de hidrogen singurul proton din nucleu formează însuşi nucleul atomului. Astfel, protonul se mai notează şi cu simbolul H+, simbolul ionului de hidrogen, adică al unui atom de hidrogen care şi-a cedat singurul electron din înveliş. Deci protonul, p+, este sinonim cu ionul de hidrogen, H+.
Conform teoriei acido-bazice a lui Svante Arrhenius (chimist suedez), numită şi teoria disociaţiei electrolitice, avem următoarele definiţii:
- Acid: orice compus care conţine H şi care, la dizolvarea în apă, cedează ioni de hidrogen.
- Bază: orice compus care la dizolvarea în apă pune în libertate ioni hidroxil, HO-.
Exemplu – Dizolvarea HCl gazos în apă:
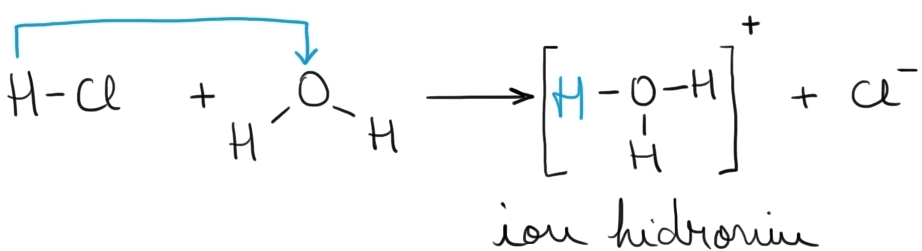
Fiecare moleculă de HCl cedează un proton; în soluţie, protonul nu poate exista liber, fixându-se astfel de o moleculă de apă şi formând ionul hidroniu, H3O+.
Exemplu – Dizolvarea NaOH în apă:

Ionii Na+ şi HO- care se găsesc în structura solidă a compusului disociază complet în apă; ionul Na+ este hidratat de m molecule de apă.
Teoria propusă de Arrhenius este limitată la reacţii care au loc în apă. Cu timpul s-a observat că mulţi alţi compuşi se comportă ca acizi şi baze chiar dacă nu este prezentă apa.
Transferul de protoni stă la baza reacţiilor dintre acizi şi baze.
Reacţia de neutralizare este reacţia dintre un acid şi o bază care anulează atât aciditatea, cât şi bazicitatea compuşilor implicaţi. În general, produşii reacţiei de neutralizare sunt o sare şi apă.
Teoria Brönsted-Lowry sau teoria protolitică:
- Acid: orice substanţă care poate dona un proton către o altă moleculă (donor de H+);
- Bază: orice substanţă care poate accepta un proton (acceptor de H+).
Conform teoriei protolitice, sunt consideraţi acizi şi compuşii precum ionul hidroniu (H3O+), ionul amoniu (NH4+), ionul carbonat acid (HCO3-). De asemenea, sunt considerate baze şi molecule precum amoniacul, dar şi anioni precum Cl-, SO4-, CO32-, HSO4-, deoarece pot accepta protoni, trecând în acizii corespunzători.
Clasificarea acizilor după numărul de protoni cedaţi de o moleculă:
- monoacizi: cedează un singur proton (HCl, HI, HNO3);
- poliacizi: pot ceda 2 sau mai mulţi protoni (H2S, H2SO4 – diacizi; H3PO4, H3AsO3 – triacizi); poliacizii cedează protoni (sau ionizează) în trepte.
Orice acid, prin cedare de protoni, se transformă într-o specie chimică cu caracter de bază şi se numeşte baza conjugată a acidului.
Orice bază, prin acceptare de protoni, se transofrmă într-o specie chimică cu caracter acid şi se numeşte acidul conjugat al bazei.
Exemplu – Reacţia ionului amoniu cu apa:
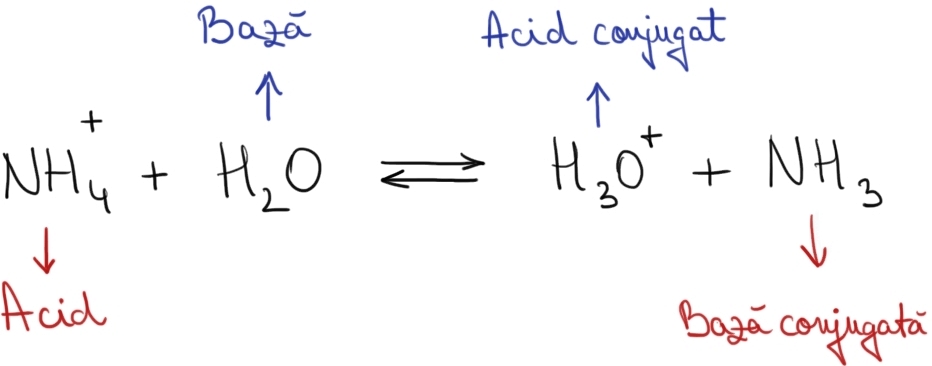
Exemplu – Cupluri acid-bază conjugate:
- HCl/Cl- sau HCN/CN-, unde ionii Cl- şi CN- sunt bazele conjugate;
- NH4+/NH3, unde NH3 este baza conjugată.






