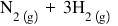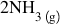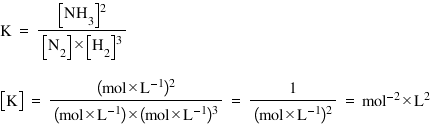Echilibre chimice – legea acţiunii maselor
Partajeaza in Google Classroom
Teorie: Teorie - Echilibrul chimic. Legea acţiunii maselor. Descarcă PDF
Echilibrul chimic. Legea acţiunii maselor.
În cazul celor mai multe reacţii chimice rezultatul final este un amestec de reactanţi şi produşi de reacţie.
Reacţia directă este reacţia prin care reactanţii formează produşi de reacţie.
Reacţia inversă este reacţia de descompunere a produşilor de reacţie în reactanţii iniţiali.
Reacţia directă şi reacţia inversă au loc continuu, în acelaşi timp, pînă când se atinge echilibrul chimic. Atingerea echilibrului chimic nu înseamnă că se opresc cele două reacţii, ci că nu se mai înregistrează schimbări în concentraţiile reactanţilor şi produşilor.
Reacţia reversibilă presupune o reacţie directă (prin care reactanţii formează produşi de reacţie) care este perfect echilibrată de o reacţie inversă (prin care produşii se descompun înapoi în reactanţi). De la punctul în care o reacţie reversibilă atinge echilibrul nu mai există variaţii vizibile în concentraţiile speciilor chimice implicate.
Reacţia reversibilă se reprezintă cu două săgeţi: o săgeată cu sensul spre dreapta desemnând sensul formării produşilor de reacţie, şi o săgeată cu sensul spre stânga desemnând sensul descompunerii produşilor în reactanţi.
Starea de echilibru într-o reacţie chimică reprezintă momentul în care procesul de formare al produşilor unei reacţii (progresul reacţiei spre dreapta) este în echilibru perfect cu procesul invers de descompunere al produşilor în reactanţi (progresul reacţiei spre stânga).
Vom exemplifica toate aceste noţiuni prin reacţia de obţinere a amoniacului:
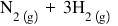

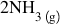
Reacţia directă şi reacţia inversă se produc în acelaşi timp: imediat ce s-a format NH3, o parte din el se descompune în H2 şi N2, iar aceste procese de formare şi descompunere se întâmplă continuu până când concentraţiile gazelor participante la reacţii ajung la valori bine determinate, adică se atinge starea de echilibru.
- Reacţia directă:
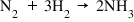
- Reacţia inversă:
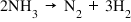
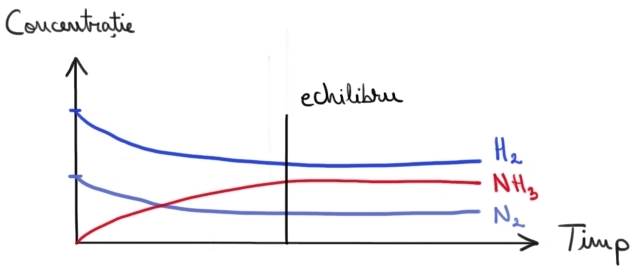
Evoluţia, în timp, a concentraţiilor gazelor din instalaţia de obţinere a amoniacului.
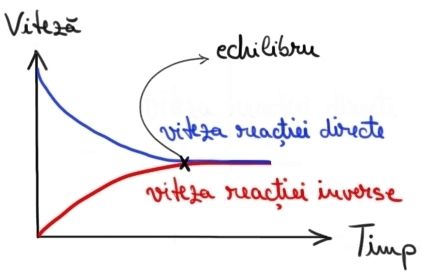
Evoluţia, în timp, a vitezei reacţiei directe (de formare a amoniacului) şi a reacţiei inverse (de descompunere a amoniacului în reactanţi).
La echilibru viteza reacţiei directe este egală cu viteza reacţiei inverse.
Legea acţiunii maselor arată că raportul dintre produsul concentraţiilor produşilor de reacţie şi produsul concentraţiilor reactanţilor, ridicate la o putere egală cu valoarea coeficienţilor stoechiometrici, este constant la atingerea stării de echilibru la o anumită temperatură.
Pentru o reacţie generală de forma:
aA + bB  cC + dD
cC + dD
în care literele mici reprezintă coeficienţii stoechiometrici ai reacţiei, iar literele mari sunt reactanţii, respectiv produşii, legea acţiunii maselor se reprezintă prin următoarea relaţie:
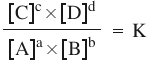
- K – constanta de echilibru: are o valoare constantă, valabilă numai pentru o temperatură specifică, de obicei precizată;
- Exponenţii din această relaţie – sunt coeficienţii stoechiometrici ai reacţiei;
- Valorile scrise între paranteze pătrate – exprimă molaritatea/concentraţia molară.
Exemplu – expresia constantei de echilibru şi aflarea unităţii de măsură pentru reacţia de obţinere a amoniacului: