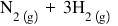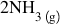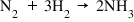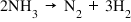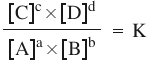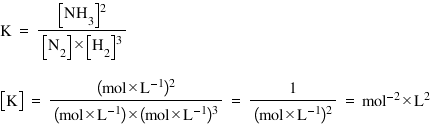Echilibre chimice – legea acţiunii maselor
Partajeaza in Google Classroom

Transcript
Cu toții ne străduim să ajungem
la un echilibru între muncă a sau
școală teme și proiecte pe de o
parte și timp liber care înseamnă
prieteni sport și filme sau alte
moduri Pe de altă parte avem nevoie
de amândouă așa că zi de zi Încercăm
să echilibrăm balanța între viața
academică sau profesională și viața
personală la fel se întâmplă și
natură cu reacțiile chimice ia
obișnuit să ne gândim la reacțiile
chimice ca având un început și
un final începem cu un niște reactanți
se întâmplă ceva timp pe acolo
Adică reactantii noștri reacționează
și apoi obținem un produs si Gata
Asta e tot asta e reacția chimică
e bine Nu e deloc așa în cele mai
multe cazuri nu obținem produsul
rezultatul fiind un amestec de
reactanți și produși la fel cum
și pentru noi fiecare zi eu încercare
Constanța de echilibru între cele
două tipuri de activități nici
reacțiile chimice nu se termină
niciodată ceea ce se întâmplă de
exemplu în cazul acestei reacții
este că cei doi reactanți formează
produșii de reacție în acest caz
un singur produs de reacție iar
aceasta ei se numește reacție direct
în același timp are loc și o reacție
de descompunere a produșilor în
reactanți inițiali prin ceea ce
se numește reacții inverse aceste
două reacții au loc întruna până
când se atinge echilibrul chimic
și când se atinge echilibrul chimic
nu înseamnă că stau pe cele două
reacții și doar că nu se mai înregistrează
schimbări în consultanților și
concentrația produse amoniacul
în paranteză înseamnă că vorbim
despre compuși în stare gazoasă
amoniacul se obține la nivel industrial
prin combinarea elementelor azot
și hidrogen în anumite condiții
de lucru de temperatură presiune
și catalizator condiții determinate
de oamenii de știință pentru a
maximiza producția acest proces
Industrial se numește procedeul
Hambar și este extrem de important
pentru noi toți chimistul german
Fritz haber Este cel care a făcut
posibilă obținerea amoniacului
din azotul care se găsește din
pline în atmosferă ca o mică paranteză
vă spun că povestea acestui triunghi
este chiar controversată și vă
sfătuiesc să o Căutați pentru că
ridică niște probleme foarte interesante
În ceea ce privește responsabilitatea
civilă a chimiști inginer tabăra
primit premiul Nobel în 1918 pentru
descoperirea lui dar peste numai
câțiva ani a fost considerat criminal
de război pentru că procedeului
a făcut posibilă obținerea explozibilul
folosit în cele două războaie mondiale
iar pe de alta parte același procedeu
este responsabil pentru susținerea
milioane de vieți omenești pentru
că a dus la obținerea îngrășămintelor
chimice practic revoluționari cultura
moderne amoniacul e o substanță
gazoasă stabilă în condiții obișnuite
de temperatură și presiune instalație
de obținere a amoniacului se introduc
elementele azot și hidrogen în
stare gazoasă sinteza are loc la
temperaturi și presiuni ridicate
după analiza gazelor care părăsesc
instalația sa constatat că din
instalație nu este numai amoniac
ci și azot și hidrogen adică materiile
Prime la 500 de grade Celsius și
la presiunea de 600 de atmosfere
amestecul final de gaze contine
42% amoniac și 58% azot și hidrogen
asta datorită reacției inverse
prin care amoniacul format se descompune
în elemente reacția directă și
reacția inversă se produc în același
timp imediat ce sa format amoniacul
o parte din el se descompune în
jos și hidrogen și tot așa până
când concentrațiile gazelor participante
la reacție au valori bine determinate
adică se atinge starea de AccuWeather
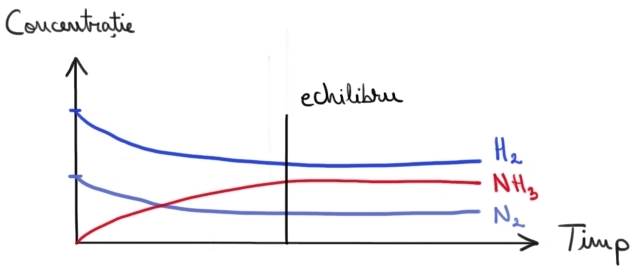
ce se întâmplă de fapt în instalația
de sinteză pentru asta ne vom folosit
de două grafice la roată evoluția
în timp a concentrațiilor gazelor
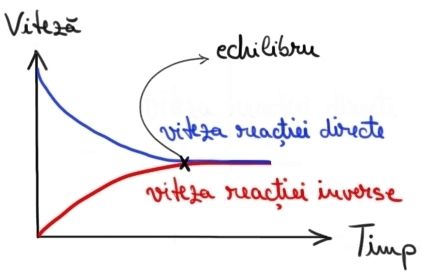
din instalație iar al doilea arată
evoluția în timp a vitezei reacției
directe de formare a Maniac și
a vitezei reacții inverse de descompunerea
amoniacului când intră geniul și
azot reacționează pentru a forma
amoniac concentrațiile celor două
gaze Scade concentrația hidrogenului
și scade și concentrația azotului
ce se micșorează și probabilitatea
a particulelor de a se ciocni unele
de altele și de a reacționa așa
că și viteza reacției directe scade
în același timp concentrația de
amoniac crește mai multe molecule
de amoniac abia formate Sunt gata
să se descompună în elementele
din care sunt formate ca și consecință
viteza reacții inverse se mărește
în final cele două reacții ating
un pom care vor avea loc la aceeași
viteză de la cel.ro ma ieri ați
vizibile în concentrația niciunui
gaz azotul hidrogenul Bor reacțiunea
în continuare pentru a forma amoniac
iar amoniacul va continua să se
descompună în azot și hidrogen
în același timp Ați observat Vezi
că nu am zis că reacția se oprește
La TIC reacția nu se oprește niciodată
doar că de la atingerea stării
de echilibru chirii numai cervone
noi diferențe vizibile în concentrații
pentru că tot ceea ce se întâmplă
Draw direcția este perfect echilibrat
de ceea ce se întâmplă în cealaltă
direcție și de aceea astfel de
reacții care se numesc reacții
reversibile sunt scrise cu două
săgeți așa dar am atins starea
de echilibru care înseamnă că procesul
de formare al produselor unei reacții
Deci Progresul reacției spre dreapta
a pentru că dreapta este sensul
de formare al produselor nu este
în echilibru perfect cu procesul
invers de descompunere ale produșilor
în dreapta Deci cu Progresul e
alții înspre stânga pentru că stânga
este sensul de descompunere al
produșilor în dreapta ceea ce fac
majoritatea chimiștilor și inginerilor
chimiști este de a se lupta cu
echilibru pentru a obține cât mai
multe produs dintre un proces pentru
a sta a folosesc tot felul de trucuri
variază temperatura presiunea sau
chiar concentrațiile reactanților
vom discuta mai multe într o lecție
viitoare și despre acești factori
care influențează echilibrul chei
pentru a putea prevedea randamentul
reacțiilor chimice funcție de condițiile
de temperatură sau presiune vom
studia echilibrul chimic și din
punct de vedere cantitativ Ce faci
acest lucru foarte ușor folosind
unele de legea acțiunii maselor
și de Constanta de echilibru considerați
această reacție generală literele
mici reprezintă coeficienții stoechiometrice
A reacției iar literele mari sunt
reactantii respectiv produs între
concentrațiile componentelor sistemului
aflare echilibru există această
relație ca fiind chiar Constanta
de echilibru e foarte important
Să înțelegem semnificația termenilor
căci sunt exponenții în această
relație pentru că între evaluare
a concentrațiilor este înmulțire
parantezele pătrate din formulă
lizate de chinezi pentru exprimarea
molaritatea sau concentrația molară
adică moli de solut pe litru de
soluție Constanța de echilibru
are o valoare constantă Ce este
valabilă numai pentru o temperatură
specifică Care este de obicei precizată
de datele problemei din fericire
Timiș Ciao calculat deja constantele
de echilibru pentru majoritatea
celor mai des întâlnite reacții
această relație a constantei de
echilibru exprima de fapt legea
acțiunii maselor așa dar această
lege ne arată că raportul dintre
produsul concentrațiilor produșilor
de reacție și produsul concentrațiilor
reactanților ridicate la o putere
egală cu valoarea coeficienților
stoichiometric este constant la
ati stări de echilibru la o anumită
temperatură Haideți să vedem Care
este expresia constantei de echilibru
pentru două echilibru primul chiar
reacția de obținere a amoniacului
avem o moleculă de azot gazos și
trei molecule de hidrogen gazos
și obținem două molecule de amoniac
valoarea constantei de echilibru
va fi dată deci de produsul dintre
concentrațiile produșilor de reacție
și în acest caz Avem doar concentrația
amoniacului la puterea a doua a
doi fiind coeficientul stoechiometric
supra produsul dintre concentrațiile
reactanților de concentrație multiplă
cu concentrația hidrogenului azotul
are Costi centrul stoichiometric
1 De cine are rost să scriem că
e la puterea 1 iar concentrația
hidrogenul lui la puterea a treia
pentru că hidrogenul are cu ochi
centrul stoechiometric egale cu
3 al doilea echilibru pe care îl
luăm Ca exemplu este chiar reacția
de obținere a acidului iodhidric
din hidrogeni și Ion și vedem că
dintre moleculă de hidrogen și
dejun obținem două molecule de
acid clorhidric expresia constantei
de echilibru va fi Deci concentrația
acidului clorhidric la puterea
a doua supra produsul dintre concentrațiile
hidrogenului și iod unitățile de
măsură folosite pentru Constanța
de echilibru sunt cele folosite
și pentru concentrația molară dar
ridicate la putere egal cu coeficienții
stoechiometrici din ecuația de
echilibru pulhac Haideți să stabilim
unitățile de măsură pentru constantele
de echilibru ale celor două liber
de mai înainte înainte o să fac
o mică precizare Vă reamintesc
de la matematică Kemal supra litru
se mai poate scrie și moli ori
litru la puterea minus Deci ca
să nu avem fracții supra supraetajate
ne va fi mai ușor să folosim în
mall ori litru la minus unu ca
unitate de măsură pentru concentrația
molară vedere matematică este exact
același lucru deci Constanta echilibrului
de obținere a amoniacului este
egală cu molar litru la minus 1
totul la puterea a doua pentru
că acesta este coeficientul stoechiometrica
al amoniacului în ecuație supra
moluri litru la minus 1 ori molar
litru la minus 1 totul la puterea
a treia simplificăm doi cu trei
și vedem că unitățile de măsură
ale Constanței noastre de echilibru
vor fi mușchilor litru la minus
1 ori moluri de tine și nu Deci
unul supremo la a doua ori litru
la minus 2 și ca să scriem și mai
elegant de atât unitatea de măsură
a Constanței de echilibru va fi
egală cu Moly La litru la puterea
a doua în cel de al doilea că azi
Constanta de echilibru este egală
cu molar de tu la minus 1 la puterea
a doua supra Mall la minus 1 ori
mallul litru la minus unu ceea
ce avem la numitor este egal cu
ceea ce avem la numărător Deci
rezultă că în acest caz Constanța
de echilibru nu are dimensiuni
Constanța de echilibru în nu are
dimensiuni de Chest dimensională
în cazurile în care suma puterilor
la care sunt ridicate concentrațiile
este aceeași la numărător și la
numitor dar Timiș știind nu cunosc
doar constantele de echilibru te
cunosc și cât anume dintre o substanță
este disponibil și Singurul lucru
pe care îi mai trebuie să le afle
este cantitatea exact de substanță
prezentă la echilibru asta se poate
afla prind un calcul destul de
simplu despre care vom vorbi chiar
lecția viitoare