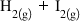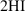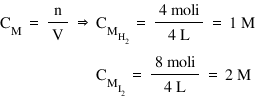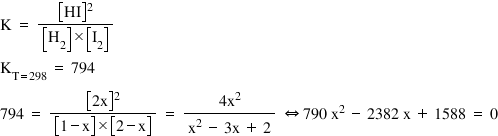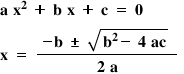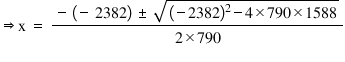Echilibre chimice – aplicaţie
Partajeaza in Google Classroom

Transcript
am vorbit data trecută despre faptul
că o reacție chimică în nu merge
întotdeauna numai în sensul formării
produselor în foarte multe cazuri
pe lângă această reacție directă
există și o reacție invertor Adică
o parte din produs și abia Formați
se și descompunerea apoi în dreapta
în momentul în care produși se
formează cu aceeași viteză cu care
se se descompun adică viteza reacției
directe este egală cu viteza reacției
inverse și pe lângă asta concentrațiile
substanțelor implicate în reacție
se stabilizează la valori bine
determinate spunem că reacția respectivă
eighteen starea de echilibru echilibrul
chimic poate fi studiat din punct
de vedere cantitativ Folosind un
net de lege acțiunii maselor și
dk Constanța de echilibru legea
acțiunii maselor arată că pentru
o reacție de forma acesteia concentrațiile
la echilibru satisfacă această
relație unde k este Constanța de
echilibru literele mici a b c și
d sunt colicii stoechiometrici
ai reacției iar literele mari a
b c și d între paranteze pătrate
reprezintă concentrațiile molare
ale substanțelor exprimate în moli
pe litru pentru a maximiza cantitatea
de substanță obținută din un proces
chimic chimiștii variază o temperatura
presiunea ei sau concentrațiile
unor substanțe care participă la
reacția vedem cum determini știi
cât dintre anume substanță e prezentă
la echilibru sau câtă substanță
mai trebuie să adauge sau cu cât
să crească temperatura ei sau cu
cât sare de presiune pentru a ajunge
la productivitate maximă adică
pentru a ajunge la rezultatele
dorite de industrie și nu le timpul
pe care își doresc reacțiile echilibru
care pe noi ca și consumator nu
ne prea ajută e bine chimiștii
să folosesc de matematică pentru
a afla răspunsurile la aceste întrebări
Dacă nu ați înțeles De ce ar trebui
să învățați ecuațiile de gradul
doi la matematică veți vedea imediat
la cele mai putem folosi unele
constante de echilibru pentru condiții
specifice de lucru sunt deja calculate
și tablete în cărți de specialitate
să zicem că suntem pentru laborator
și cunoaștem și ce cantități de
substanță avem disponibile pentru
o anume reacție tot ce mai trebuie
să aflăm este cantitatea exacte
de substanță prezentă la echilibru
Apoi dacă este cazul vom varia
parametri care influențează reacția
pentru a ajunge la un rezultat
dorit de noi acest tip de calcul
este foarte ușor dacă folosim în
tabel pe care eu le am de numi
tine ca să fie mai ușor de reținut
Deci avem tabelul unde irvine de
la ecuația reacției e vine de la
concentrația inițială m de la modificare
a concentrației iar a vine de la
concentrația la echilibru trebuie
să aflăm care este compoziția la
echilibru pentru reacția dintre
hidrogen și Ion dacă știm că are
o constantă de echilibru de 794
la temperatura de 25 de grade c
25 grade Celsius adică 298 de grade
Kelly deci pe rândul R vom scrie
ecuația reacției pe rândul scrie
în concentrațiile inițiale întotdeauna
pe acest rând vor exista și valori
de 0 molari deoarece până când
începe reacții ar Nu avem cum să
cunoaștem toate concentrație există
cazuri când știm concentrația inițială
a produsului și nu cunoaștem concentrațiile
inițiale ale elementelor în care
produsul să va descompune pentru
că logic descompunerea nu a început
sau există cazuri în care cunoaștem
inițial numai concentrațiile reactanților
în cazul nostru în ni se spune
că un vas de 4 L Deci avem volumul
egal cu 4 L se introduc 4 moli
de hidrogen și opt moli de iod
asta înseamnă că Putem afla concentrațiile
molare inițiale ale reactanților
iar concentrația inițială a produsului
va fi 0 molari pentru că încă nu
sa format nici un mol de acid util
concentrația molară este egală
cu numărul de moli supra volum
Deci concentrația molară a hidrogenului
va fi de 4 moli supra 4 L adică
egală cu un Mall pe litru iar concentrația
molară a iodului este de 8 moli
supra 4 L de ce este egală cu 2
moli pe litru și vom completa aceste
valori linia e a tabelului pe linia
a mări cât din substanță se va
modifica în timpul reacției cel
mai des nu avem de unde să știm
acest lucru până când nu facem
calculele așa că vom nota acea
valoare cu x acolo unde nu cunoaștem
cantitățile Petro reacție reactanți
se consumă Deci numărul de moli
de reactanți se modifică cu un
minus de sixt reprezintă cantitatea
de reactanți care se consumă pentru
a forma acidul citric în condițiile
de temperatură și presiune vedem
că conform ecuației reacției un
mol de hidrogen și un mol de iod
se combină pentru a forma a doi
moli de acid clorhidric deci putem
spune că hidrogenul și iodul vor
pierde fiecare câte x moli pe litru
și în timp ce concentrațiile de
hidrogen și iod scad concentrația
de acidul citric samur Deci dacă
se mărește cu 2x moli pe litru
Așadar aici va fi plus 2x pe linia
e trecem rezultatul final adică
ce cantitate anume din fiecare
substanță va fi prezentă la echilibru
deoarece cantitatea finală este
pur și simplu cantitatea inițială
plus cantitatea care stă modificată
în timp iei această linie reprezintă
suma dintre linia e și linia A
deci în cazul hidrogenului vom
avea 1 minus în cazul iodului vom
avea 2 minus x iar în cazul acidului
iodhidric bommel bea 0 plus 2 x
adică 2 x 5 Știind că toate valorile
sunt exprimate în moli pe litru
reprezintă concentrației molare
acum aplicată valori la formula
pentru Constanta de echilibru iar
relația constantei de echilibru
pentru relația noastră este aceasta
constantă de echilibru este egală
cu concentrația acidului iodhidric
la puterea a doua supra a concentrației
hidrogenului înmulțită cu concentrația
iodului pentru această reacție
la temperatura de 298 de Kelvin
k este egal cu 794 acum vom înlocui
în această reacție valorile concentrațiilor
pe care le am obținut nouă la echilibru
Deci 794 este egal cu 2x la puterea
a doua supra 1 minus x ori 2 minus
x și efectuând niște calcule simple
ajunge această relație pe care
o recunoaștem ca fiind o ecuație
de gradul doi deci pe care o rezolva
ca atare și ca în cazul oricărei
coasei de gradul 2 obținem două
valori pentru x și anume x egal
cu 0 virgulă 995 x egal cu 2 să
ne reamintim că pentru noi aceste
valori reprezintă concentrației
molare deci vorbim despre 0 95 moli
pe litru sau despre 2 moli pe litru
iar în cazul nostru numai o valoare
Este corectă dacă ne uităm la valorile
inițiale Ale concentrațiilor ne
dăm seama că e imposibil ca x să
fie 2 molar având în vedere că x
reprezintă cantitatea care se pierdu
din numărul de moli inițial Deci
nici genul nici iodul nu aveau
Cum să piardă 2 moli pentru că ăsta
a început cu mai puțin de atât
Așadar valoare pe care o căutăm
este x egal cu 0 virgulă 995 moli
pe litru Acum putem calcula compoziția
la echilibru pentru fiecare substantiv
la echilibru în condițiile specificate
cantitatea de la acidul citric
este 2 ori 0 95 adică este 1 mult
pe net concentrația de hidrogen
este 1 minus 0 virgulă 995 adică
0 moli pe litru iar concentrația
de iod este 2 minus 0 virgulă 995
adică 1 5 moli pe litru după cum
vom vedea Alexia viitoare aceste
valori pot fi modificate de exemplu
pentru a maximiza producția de
asigure hidric putem schimba temperatura
sau presiunea chiar concentrațiile
substanțelor care participă la
reacție în cazul a acidului iodhidric
creșterea temperaturii ar duce
la favorizarea reacții inverse
adică a reacției de descompunere
în intro gen și iod și Știu asta
deoarece Pe măsură ce crește temperatura
valoarea constantei de echilibru
se micșorează am văzut că pentru
298 de Kelvin Constanta este egală
cu 794 la 700 Kelvin Constanta
de echilibru are o valoare de 54
iar la 1000 de Kelvin Constanta
de echilibru este egală cu 29 astfel
ne dăm seama că Pe măsură ce crește
în temperatura x adică valoarea
cu care se modifică concentrația
substanțelor scade Spre exemplu
am făcut și calculul pentru temperatura
1000 de Kelvin când Constanța de
echilibru este egală cu 29 tot pentru
o situație în care avem un moli
pe litru de hidrogen și 2 moli
pe litru de jos iar valoarea lui
x în aceste condiții este 0 spre
diferență de 0 95 cât mai a dat
când a făcut calculul pentru temperatura
de 298 de k l de aici trage concluzia
că formarea de acid uric este favorizată
la temperaturi mai jos Așadar cunoașterea
valorii constantei de echilibru
permite să se prevadă sensul în
care se produce reacția chimică
și există trei cazuri principale
când Constanta e mai mare decât
1 înseamnă că sistemul e deplasat
spre Da adică eu favorizată formarea
produșilor de reacție când valoarea
constantei e mai mică decât 1 sistemul
e deplasat spre stânga adică e
favorizată existența reactanților
și nu formarea produșilor de reacție
iar când valoarea constantei este
egală cu unu toate speciile chimice
sunt la echilibru în aceeași proporție
adică echilibrul nu e deplasat
în nicio direcție echilibrele chimice
pentru care Constanta de echilibru
este cu mult mai mare decât 1 cel
puțin de ordinul 10 la a treia
adică 1000 pot fi considerate în
practică reacții totale adică reacții
în care întreaga concentrație de
react este convertită în cadrul
reacții chimice în produși am văzut
lecția aceasta cu un puțin algebră
în este foarte utilă în aplicațiile
practice de la chimie câteva calcule
și pute maximizat producție unor
substanțe de care avem nevoie în
lecția viitoare vom vorbi și despre
factorii care influențează echilibrul
chimic adică despre parametrii
pe care trebuie să modificăm în
funcție de ce ne dă calculele matematice