Legături covalente în compuşii organici
Partajeaza in Google Classroom
Teorie: Teorie - Legături covalente în compuşii organici Descarcă PDF
Legătura covalentă se formează prin punerea în comun de electroni neîmperecheaţi, adică prin întrepătrunderea a doi orbitali monoelectronici. Astfel, se formează un orbital molecular de legătură.
Atomul de carbon are doi orbitali monoelectronici, adică doi orbitali care conţin, fiecare, câte un electron. Aceşti orbitali, în stare fundamentală, nu asigură întrepătrunderea maximă necesară formării legăturilor covalente stabile. De aceea, în timpul reacţiilor chimice, orbitalii în care se găsesc electronii de valenţă ai carbonului suferă un proces de hibridizare.
Hibridizarea este procesul de redistribuire a electronilor de valenţă în noi orbitali, în orbitalii hibrizi.
Orbitalii hibrizi au o nouă formă, o nouă energie, şi o nouă orientare în spaţiu faţă de orbitalii atomici. Formarea legăturilor covalente este favorizată atât energetic cât şi steric.
Atomii de carbon, de azot, şi de oxigen formează orbitali hibrizi.
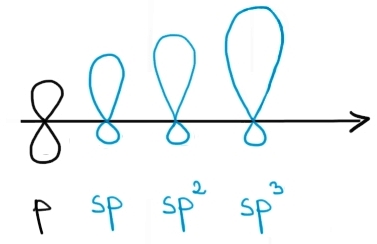
Cele mai importante hibridizări adoptate de atomii din compuşii organici sunt hibridizările sp3, sp2 şi sp. Atomul de carbon adoptă toate cele 3 tipuri de hibridizare, în funcţie de natura legăturii covalente pe care o stabileşte cu alţi atomi.
Atomul de carbon are 4 electroni de valenţă şi poate forma 4 legături covalente. Legăturile covalente din compuşii organici pot fi:
- legături covalente simple: C – C;
- legături covalente duble: C = C;
- legături covalente triple: C ≡ C.
Imaginea de mai jos compară volumele orbitalilor hibrizi cu volumul unui orbital p:
Hibridizarea sp3 la atomii de carbon: prin combinarea orbitalului 2s cu cei 3 orbitali 2p ai carbonului rezultă 4 orbitali hibrizi sp3. Cei 4 orbitali sp3 astfel obţinuţi au aceeaşi energie, mai mare decât a orbitalului 2s şi mai mică decât a orbitalilor 2p.
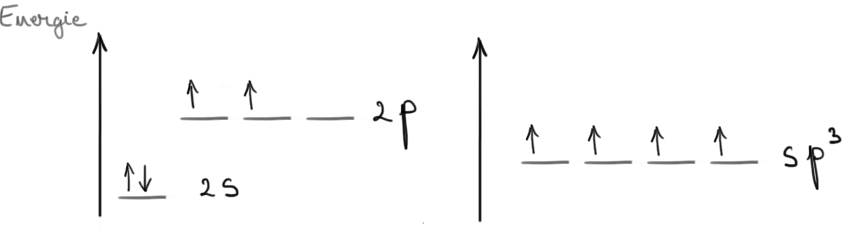
Orientarea spaţială este tetraedrică. Prin intermediul orbitalilor hibrizi sp3, atomul de carbon formează numai legături covalente simple care se mai numesc şi legături σ (sigma). Pentru a se forma o legătură σ, 2 atomi pun în comun o pereche de electroni. Aşadar, atomul de carbon hibridizat sp3 poate forma 4 legături σ.
Hibridizarea sp2 la atomii de carbon: presupune combinarea orbitalului 2s cu 2 orbitali 2p. Rezultă 3 orbitali hibrizi sp2 şi un orbital p nehibridizat. Orbitalii sp2 au formă bilobală cu un lob extins. Au energie mai mare decât a orbitalului 2s şi mai mică decât energia orbitalior 2p.
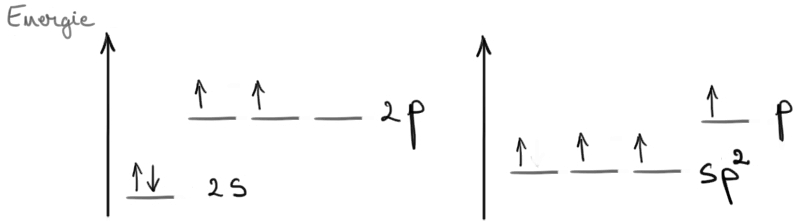
Un atom de carbon hibridizat sp2 realizează 3 legături σ cu cei trei orbitali hibrizi sp2, iar cu orbitalul p nehibridizat, realizează o legătură π (pi). Aşadar, atomul de carbon sp2 realizează o legătură dublă, formată dintr-o legătură σ şi o legătură π, şi 2 legături σ.
Hibridizarea sp la atomii de carbon: presupune combinarea orbitalului 2s cu un orbital 2p, combinare din care rezultă 2 orbitali hibrizi sp. Orbitalii sp au formă bilobală cu un lob extins. Au energia mai mare decât a orbitalului 2s, şi mai mică decât a orbitalilor 2p.
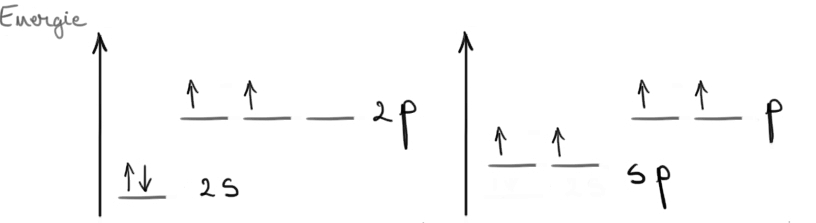
Un atom de carbon hibridizat sp realizează 2 legături σ cu cei doi orbitali hibrizi sp, şi 2 legături π cu cei doi orbitali p nehibridizaţi. Aşadar, atomul de carbon hibridizat sp poate realiza o legătură triplă şi o legătură simplă, sau poate realiza 2 legături duble. Legătura triplă este formată din 2 legături π şi o legătură σ.
Atomii de azot pot avea şi ei aceste trei tipuri de hibridizări, sp3, sp2, şi sp, aşadar, şi atomii de azot pot forma legături duble sau triple.
Atomii de oxigen poate avea numai hibridizare sp3.
Tăria unei legături covalente depinde, printre alţi factori, şi de forma orbitalului molecular de legătură care se formează. Legătura π este mai slabă şi mai reactivă decât legătura σ.






