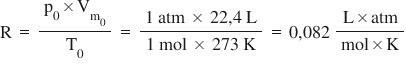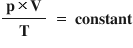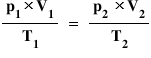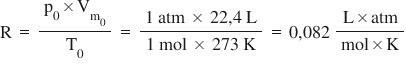Legea generală a gazelor
Gazele sunt substanțe care ocupă tot volumul recipientelor în care se află. Recipientul trebuie să fie închis pentru ca o substanță gazoasă să rămână acolo.
Volumul molar, Vm are valoarea 22,4 L/mol și reprezintă volumul pe care îl ocupă un mol din orice gaz în condiții normale de presiune și temperatură.
Condițiile normale de temperatură și presiune se referă la următoarele valori:
T = 273,15 K (sau 0° C)
p = 1 atm
Parametrii de stare ai unui gaz sunt mărimile care caracterizează starea unui gaz la un moment dat, și sunt următoarii trei: presiunea (p), temperatura (T), și volumul (V).
Comportamentul gazelor reale începe să devieze de la comportamentul gazelor ideale în special atunci când se creează condiții propice pentru moleculele de gaz de a forma legături intermoleculare:
- la presiune ridicată;
- la temperatură joasă;
- la densitate mare.
Legea generală a gazelor a fost obținută prin combinarea mai multor legi simplificate care descriu comportamentul gazelor reale. Este nevoie de această lege deoarece legea gazelor ideale nu poate fi aplicată în orice condiții. Așadar, legea generală a gazelor prezintă relația matematică dintre cei trei parametri de stare ai unui gaz pentru o cantitate fixă de gaz:
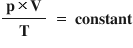
Pentru a descrie un sistem gazos care trece dintr-o stare inițială (1) într-o stare finală (2), putem folosi tot legea generală a gazelor în următoarea formă:
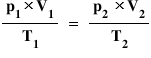
Constanta molară a gazelor perfecte, R este o constantă care se referă la toți cei trei parametri de stare standard ai gazelor, și are aceeași valoare pentru orice gaz, fie el real sau ideal. R are mai multe valori numerice, în funcție de unitățile de măsură ale parametrilor de stare.
Exemplu – Calculul valorii lui R în condiții normale când presiunea e exprimată în atmosfere, volumul în litri, iar temperatura în K: