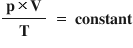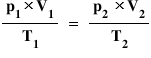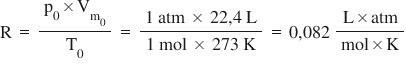Legea generală a gazelor
Partajeaza in Google Classroom

Transcript
data trecută am văzut cum putem
identifica anumite proprietăți
ale gazelor folosind numele de
lege a gazelor ideale lege care
spune că produsul dintre presiunea
și volumul unui gaz este egal cu
produsul dintre numărul de moli
aer Constanța gazelor ideale și
temperatura gazului respectiv este
deci întotdeauna același număr
și dacă știi trei dintre ceilalți
patru parametri ai gazul putea
calcula fără probleme al patrulea
parametri dar după cum spune și
denumirea legea este un model de
comportament al gazelor în circumstanțe
ipotetice și de el iar deși Noi
am preferat general acesta mai
simplificat al gazelor ideale în
realitate lucrurile sunt ceva mai
interesante știm că spre deosebire
de substanțele lichide și solid
gazdele ocupă tot volumul vasului
în care se află ia vasul sau recipientul
trebuie să fie bineînțeles închis
După multe experimente a determinat
că un mol din orice gaz în condiții
normale de presiune și temperatură
ocupă un volum de 22 l acesta fiind
de aici volumul molar după cum
au convenit oamenii de știință
care au efectuat experimentele
condițiile normale de presiune
și temperatură se referă la o temperatură
de 273 virgulă 15 grade Kelvin
care corespunde la o temperatură
de 0 grade Celsius și la o presiune
de o atmosferă Deci în aceste condiții
de 273 virgulă 15 Kelvin și o atmosferă
este egal cu 22 l pe more mai mult
Haideți să ne reamintim de legea
lui avogadro conform căreia volumele
conțin același număr de particule
cu toate că masele substanțelor
sunt diferite Tot prin experimente
este determinat că un mol din orice
substanță conține 6 de la puterea
23 particule oricare ar fi condițiile
de temperatură presiune sau stare
de agregare a substanței după cum
bine știi măceș număr foarte foarte
mare cu 23 de zerouri se numește
numărul lui avogadro și să notează
cu N a Bun deci numărul lui avogadro
este o constantă universală care
reprezintă numărul de particule
atomi Ioni sau molecule conținute
pentru un mol de substanță asta
a fost o mică paranteză ca să ne
reamintim de avogadro dacă dublăm
numărul de moli de gaz dintre un
vas logic și volumul se dublează
când temperatura și presiunea sunt
constante Deci volumele de gaz
măsurat în condiții constante de
presiune și temperatură sunt direct
proporționale cu numărul de moli
de gaz iar relația matematică este
aceasta volumul gazului este egal
cu numărul de moli înmulțit cu
volumul molară a gazului rezultă
că numărul de moli al oricărui
gaz poate fi de duș foarte ușor
cu această relație numărul de moli
de gaze este egal cu volumul supra
volumul molară a gazului există
trei parametri de stare sau trei
mărimi care caracterizează starea
unui gaz la un moment dat acești
parametri sunt pe adică presiunea
de temperatura și vei adică volumul
gazului prin experimente se determina
că volumul variază invers proporțional
cu presiunea dar variază direct
proporțional cu temperatură până
aici lucrurile ne sunt familiare
am mai vorbit și lecția trecută
despre asta din perspectiva gazelor
Mihai relația matematică dintre
cei trei parametri de stare ai
unui gaz pentru o anume cantitate
de gaz este Deci aceasta produsul
dintre presiune și volum împărțit
la ei temperatură este constant
dacă am scrie că produsul dintre
presiune și volum supra temperatură
este egal cu produsul dintre numărul
de moli și Constanța gazelor ideale
am avea chiar legea gazelor ideale
pentru că această relație este
echivalentă cu aceasta și multă
vreme oamenii de știință au analizat
comportamentul gazelor doar cu
această legea gazelor ideale dar
în majoritatea cazurilor acele
calcule dădeau rezultate care nu
corespundeau cu rezultatele experimentale
atunci unii oameni de știință observat
că în situațiile în care particulele
de gaz se aglomerează Adică sunt
nevoită să se apropie mai mult
unele de altele comportamentul
gazelor reale începe să devieze
de la cel al datelor ideale care
respectă legea pe ore egal cu n
ori erori particulele de gaz se
apropie mai mult unele de altele
în trei situații aceste situații
sunt presiune ridicată temperatură
joasă sau densitate mare Deci observat
oamenii de știință că în aceste
situații comportamentul gazelor
reale deviază de la Legea gazelor
ideale Ce observăm că de fapt aceste
situații corespund cazurilor în
care se crează condiții propice
pentru ca moleculele de gaz să
formeze legături intermoleculare
de să interacționeze moleculele
de gaze unele cu altele despre
cum gazele se transformă în starea
lor Miki de la temperaturi scăzute
datorită forțelor de dispersie
London am mai discutat și le ți
le trecut la fel se întâmplă și
în cazul presiunii ridicate moleculele
Se apropie și interacționează una
cu alta pentru că crește și Imperia
forțelor de am discutat De asemenea
și despre faptul că Forțele de
dispersie London se manifestă mai
puternică o dată cu creșterea masei
moleculare iar densitatea unui
gaz depinde direct de masă moleculară
a gazului cel care a găsit soluția
pentru problema comportamentului
gazelor reale este Iohannis Dietrich
Vanderbilt despre care Sigur vă
amintiți pentru că forțele dipoli
default și Forțele de dispersie
London a fost denumite forțe van
der waals chiar după numele lui
îi vine prima lui contribuție majoră
în chimie a fost legată de corecție
a legii gazelor ideale prin care
ele Explicați de ce nu toate gazele
se comportă așa cu un toată lumea
credea pe la sfârșitul secolului
19 sa aplicat corecții legii gazelor
corecții referitoare la volum și
la presiune corect cele referitoare
la presiune au legătură cu Forțele
intermoleculare care se manifestă
între particulele de gaz legea
a corectat de van der waals care
arată cum așa spre diferență de
lege a gazelor ideale Deci această
lege după cum vedem are o forma
foarte complicată cu care nu are
rost să ne batem noi capul acum
important este să înțelegem diferența
dintre gazele reale și cele ideale
ce să înțelegem că nu putem aplica
legea gazelor ideale în orice condiții
ce dacă ecuația lui Van Der valk
este puțin prea complexă pentru
noi la acest nivel Haideți să vedem
cum ne putem folosi mai bine de
legea generală a gazelor Ce anume
aceea care spune că produsul dintre
presiune și vol supra temperatură
este Taci să vedem cum dintre o
relație generală putem deduce chiar
noi legea gazelor și Constanta
Deci pornind de la relația matematică
dintre parametrii de stare a unui
gaz adică aceasta putem Descrie
un sistem de Jos care are inițial
volumul V1 la temperatura T1 și
la presiunea P1 ce trece între
o stare finală cu volumul V2 prin
modificarea presiunii la pe 2 și
a temperaturii la T2 iar relația
care leagă acești parametri este
aceasta deci este o relație de
egalitate acum pentru un gaz aflat
în condiții normale cu volumul
de 004 73 virgulă 15 Kelvin și
presiunea pe 0 D atmosferă putem
ține relația de mai devreme în
acest fel pe urs supra y este egal
cu 0 1 pe 0 supra 0 parametri Standard
se notează în general cu indicele
0 Deci acest indice anunță de fapt
că e vorba de valorile stabilite
prin convenție pe care le recunosc
oamenii de știință din întreaga
lume cu 0 notăm volumul molar în
condiții normale adică la 273 virgulă
15 Kelvin și o atmosferă iar conform
legii lui avogadro de care am amintit
la început volumul gazului este
egal cu numărul de moli de gaz
ori volumul molar Care este întotdeauna
22 l pe mall pentru un gaz în condiții
normale și înlocuim vezi zero în
relația de mai sus și obținem că
produsul dintre presiune și vol
supra temperatură este egal cu
produsul dintre presiune ori volumul
molar al unui gaz în condiții normale
ori numărul de moli totul supra
c 0 Acum putem Rescrie relația
în acest fel și Dacă vom nota produsul
dintre presiune și volumul la Rânca
ndi tii normale supra 3 0 Cu obținem
chiar legea gazelor ideale sau
e mai putem spune și ecuația de
stare a gazelor perfecte tot Foarte
oficial și aer se numește Constanța
molară a gazelor perfecte și este
o constantă deoarece are același
volum pentru toate gazele finele
reale sau ideale asta pentru că
se referă la acei parametrii de
stare Standard care sunt aceeași
peste tot și era ajută foarte mult
la simplificarea calculelor există
mai multe valori numerice pentru
această constanță depinzând de
unitățile parametrilor de stare
schema asta de lecția trecută de
exemplu în condiții normale când
presiunea estimată în atmosfere
volumul în litri pe Mol pentru
că e volum molar iar temperatura
în Kelvin valoarea lui i este egală
cu o atmosferă ori 22 l pe mall
totul supra 273 virgulă cinci ce
obținem valoarea lui R 0 el ori
atmosfere supra Mahler Calvin Haideți
să folosim această lege întru aplicații
să zicem că avem 15 moli de heliu
întru un vas cu un volum de 30
L iar temperatura este de 27 de
grade c și trebuie să aflăm ce
presiune exercită gazul asupra
pereților vasului ca să ne dăm
seama dacă se sparge sau nu te
sparge vasul respectiv mai întâi
calculăm temperatura în chestii
pentru că vom folosi Constanta
R care e calculată în grade Kelvin
De ce temperatura va fi egală cu
273 virgulă 15 plus 27 Deci este
egal cu 300 virgulă 15 cal Folosind
un de legea gazelor ideale stabilind
relația de calcul a valorii necunoscute
aceasta fiind presiunea Deci presiunea
este egală cu produsul dintre numărul
de moli Constanta R și T totul
supra a volumul vasului înlocuind
datele problemei aflăm presiunea
Deci presiunea este egală cu 15
moli ori 300 virgulă 15 Kelvin
ori 0 el ori atmosfere supra molar
Calvin totul supra 30 de l ca întotdeauna
trebuie să fim foarte foarte atenți
la unitățile de măsură morții simplifică
cu moli de iar la fel Calvin cu
Calvin și obținem că 369 virgulă
18l ori atmosfere supra 30 de l
este egal cu 12 zeci și unu atmosfere
Deci ne imaginăm că pereții vasului
nostru nu vor ceda la o presiune
de 12 și un pic Dacă ar fi calculat
această valoare a presiunii cu
ecuația mai complicată a lui Vanderbilt
am fi obținut exact aceeași valoare
și atunci poate vă întrebați care
e rostul ecuației lui e bine dacă
schimbăm datele problemei și ne
dăm seama că noi nu avem De fapt
heliu la 27 de grade Celsius și
la minus 200 de grade Celsius atunci
lucrurile stau cu totul altfel
diferența de presiune calculată
cum am făcut noi prin legea gazelor
ideale și calculată legea lui Van
Der waals ar fi de câteva atmosfere
asta nu e așa o mare problemă Când
calculăm o problemă pentru tine
pentru un vas de 30l Dar când e
vorba de calcule reale în procesele
industriale orice variație și orice
calcul greșit poate duce la un
accident Deci vendor vă sa prevenim
multe accidente industriale și
pentru asta a primit și eu premiul
Nobel în 1910 în fizică și nu în
chimie cumnații așteptat pentru
munca lui în stabilirea ecuațiilor
de stare pentru gaze și lichide
cam Atât deocamdată despre substanțele
gazoase de data viitoare vom vorbi
și despre soluții în special despre
soluțiile lichid