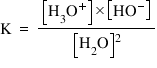pH-ul este o măsură a puterii (sau a tăriei) caracterului acid sau bazic al unei substanţe.
Apa este un amfolit acido-bazic care poate funcţiona fie ca acid, donând un proton şi transformându-se în ion hidroxil, fie ca bază, acceptând un proton şi transformându-se în ion hidroniu. Mai jos este reprezentată reacţia de autoprotoliză a apei sau reacţia globală de ionizare:
2H2O  H3O+ + HO-
H3O+ + HO-
Constanta de echilibru a reacţiei de autoprotoliză a apei:
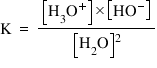
Se consideră că valoarea concentraţiei molare a apei la puterea a doua este constantă (deoarece numai o moleculă de apă din câteva zeci de milioane de molecule ionizează), iar produsul dintre K şi această constantă va fi tot o constantă, notată cu Kw: K x [H2O]2 = Kw
Kw = [HO-] x [H3O+] – produsul ionic al apei
La o temperatură de 25°C, Kw = 1,0 x 10-14 mol2/L2.
În soluţii acide: concentraţia ionilor hidroniu este mai mare decât concentraţia ionilor hidroxil.
[H3O+] > [HO-]
În soluţii neutre: concentraţia ionilor hidroniu este egală cu concentraţia ionilor hidroxil.
[H3O+] = [HO-]
În soluţii bazice: concentraţia ionilor hidroniu este mai mică decât concentraţia ionilor hidroxil.
[H3O+] < [HO-]
Definiţia matematică a pH-ului: pH-ul este egal cu logaritm zecimal negativ din concentraţia protonilor existenţi în soluţie (mai corect spus, din concentraţia ionilor hidroniu, având în vedere că protonii nu pot exista liberi în soluţie).
pH = – lg[H+]
pH-ul mai poate fi definit şi astfel: pH-ul unei soluţii este egal cu puterea cu semn schimbat a concentraţiei molare a ionilor de hidroniu.
[H3O+] = 10-pH
Când creşte concentraţia de protoni din soluţie, pH-ul scade. Iar când scade concentraţia de protoni din soluţie, pH-ul creşte.
Scala de pH măsoară cât de acidă sau cât de bazică este o substanţă. Scala de pH cuprinde valori de la 0 la 14, cu valorile între 0 şi 7 aparţinând acizilor, şi valorile între 7 şi 14 aparţinând bazelor. Valoarea pH-ului apei pure, 7, este baza scalei de pH.
Acizi: pH < 7
Baze: pH > 7
Acizii tari au, în general, pH foarte scăzut. Acizii slabi care disociază incomplet au valori de pH de la 4 la 6. Bazele tari au pH foarte ridicat. Bazele slabe au, de obicei, pH-ul între 8 şi 11.
Teoretic, pH-ul neutru este considerat ca fiind pH=7. Practic, sunt considerate ca fiind neutre toate soluţiile care au pH-ul între 6 şi 8.

 H3O+ + HO-
H3O+ + HO-