Reacţii redox. Oxidanţi şi reducători.
Partajeaza in Google Classroom
Teorie: Teorie - Reacţii redox. Oxidanţi şi reducători. Descarcă PDF
Numărul de oxidare, N.O., este o reprezentare mai generală a valenţei ce include atât electrovalenţele, pozitivă şi negativă, care se referă la transferul de electroni, cât şi covalenţa, care se referă la punerea în comun de electroni. Deci numărul de oxidare al unui atom reprezintă o sarcină pe care atomul ar putea să o aibă, teoretic, într-un compus.
Transferul de electroni stă la baza proceselor de oxidare şi reducere.
Reacţia de oxidare este procesul în care o specie chimică cedează electroni; numărul de oxidare al unui element din această specie chimică creşte.
Reacţia de reducere este procesul în care o specie chimică acceptă electroni; numărul de oxidare al unui element din acestă specie chimică scade (se reduce).
Electronii nu pot exista liberi în mediul de reacţie. Când o specie chimică cedează electroni, înseamnă că ea se găseşte în prezenţa altei specii chimice care este capabilă să accepte electronii. De aceea, procesele de oxidare şi de reducere nu pot exista independent, ci întotdeauna au loc reacţii care cuprind ambele procese. Aceste reacţii se numesc reacţii de oxido-reducere sau, pe scurt, reacţii redox.
Orice reacţie chimică care implică transferul de electroni este o reacţie redox.
În cadrul unei reacţii redox, numărul de electroni cedaţi în procesul de oxidare este întotdeauna egal cu numărul de electroni acceptaţi în procesul de reducere.
Exemplu – Procesele dintr-o reacţie redox:
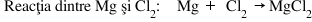
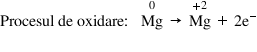

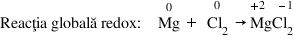
Oxidantul este specia chimică din care face parte atomul sau ionul care, într-o recţie cu transfer de electroni, acceptă electroni. Deci oxidantul este specia care se reduce.
Agentul oxidant este substanţa care conţine specia oxidant şi, deşi substanţa respectivă se reduce, ea generează oxidarea unei alte specii chimice. Sunt buni oxidanţi următorii compuşi:
- acizii oxigenaţi ai nemetalelor: HNO3 (acidul azotic), H2SO4 concentrat (acidul sulfuric), HClO4 (acidul percloric), etc;
- compuşii metalelor tranziţionale în care acestea au N.O. mari: KMnO4 (permanganatul de potasiu), MnO2 (dioxidul de mangan), K2Cr2O7 (dicromatul de potasiu), etc;
- cationii metalelor puţin active (conform seriei activităţii metalelor): Cu2+, Ag+, Au3+;
- unele substanţe elementare, respectiv elementele cu electronegativitate ridicată: F2, O2, Cl2, Br2.
Reducătorul este specia chimică din care face parte atomul sau ionul care, într-o reacţie cu transfer de electroni, cedează electroni. Deci reducătorul este specia care se oxidează.
Agentul reducător este substanţa care conţine specia reducător şi, deşi substanţa respectivă se oxidează, ea generează reducerea unei alte specii chimice. Sunt buni reducători următorii compuşi:
- metale care au caracter electronegativ foarte slab: Na, K, Mg, Ca;
- unele nemetale precum H2 şi C, şi unii oxizi ai nemetalelor cu N.O. mici precum CO;
- hidracizii: HCl, HBr, HI, H2S;
- cationii metalici cu N.O. mici.






