Soluţii. Dizolvarea compuşilor ionici şi moleculari în apă.
Partajeaza in Google Classroom
Teorie: Teorie - Soluții. Dizolvarea compușilor ionici și moleculari. Descarcă PDF
Soluții. Dizolvarea compușilor ionici și moleculari.
Soluțiile sunt amestecuri omogene formate din două sau mai multe substanțe.
Substanțele pot forma amestecuri indiferent de starea lor de agregare; amestecurile formate pot fi omogene sau eterogene.
Într-un amestec eterogen putem distinge clar substanțele care-l compun, deci un amestec eterogen este format din cel puțin două faze.
Amestecul omogen apare atunci când două, sau chiar și mai multe substanțe, se amestecă atât de bine încât par a fi devenit una singură – adică există o singură fază. Astfel iau naștere soluțiile.
O soluție se obține prin procesul de dizolvare a unuia sau a mai multor soluți într-un solvent.
Solventul sau dizolvantul este substanța care se află în cantitate mai mare, și este substanța care dizolvă alte substanțe (soluți).
Solutul, solvatul sau dizolvatul este substanța care se află în cantitate mai mică, și se dizolvă în solvent. Un solvent poate dizolva mai mulți soluți în același timp.
Exemplu – Obținerea unei soluții:
- prin amestecarea unei linguri de sare într-un pahar cu apă se obține o soluție apoasă de sare; solventul este apa, iar solutul este sarea.
Exemplu – Tipuri de soluții:
- Soluții lichide: apa de mare este o soluție lichidă în care sunt dizolvați peste 60 de soluți.
- Soluții gazoase: atmosfera pământului este o soluție gazoasă; pentru că aerul este format din aproape 79 % azot, azotul este considerat ca fiind solventul, iar oxigenul, dioxidul de carbon și celelalte gaze din aer sunt considerate soluți.
- Soluții solide: aliajele reprezintă amestecuri omogene între două sau mai multe metale; de exemplu bronzul este o soluție de zinc în cupru.
Solubilitatea este proprietatea unei substanțe de a se dizolva într-o altă substanță. Solubilitatea se referă la cantitatea de solut care se va dizolva într-o anume cantitate de solvent în anumite condiții de temperatură și presiune.
Solubilitatea depinde de:
- temperatură: în cazul solidelor, solubilitatea crește odată cu creșterea temperaturii (dependență directă); în cazul gazelor, solubilitatea scade odată cu creșterea temperaturii (dependență indirectă).
- presiune: în special solubilitatea gazelor este influențată de presiune.
- natura solventului este factorul care determină tipul de legături care se pot forma între particulele de soluți și solvenți.
Apa este un solvent extraordinar: în apă sunt solubili atât compușii ionici, cât și compușii moleculari (compușii moleculari pot forma legături de hidrogen cu moleculele de apă). Așadar, printre substanțele care se dizolvă în apă se numără substanțe ionice precum NaCl, NaOH, CuSO4 și substanțe polare precum zahărul, NH3, HCl.
Dizolvarea este un fenomen fizic în timpul căruia particulele de solut difuzează printre moleculele de solvent, până se obține un amestec omogen. În același timp cu dizolvarea se pot stabili interacții cu formare de legături între particulele de solut și de solvent, interacții care pot duce la următoarele procese:
- disocierea sau ionizarea substanțelor ionice și a substanțelor polare în ioni;
- solvatarea moleculelor sau a ionilor dizolvați cu molecule de solvent (când solventul este apa, procesul se numește hidratare).
Dizolvarea unui compus ionic în apă:
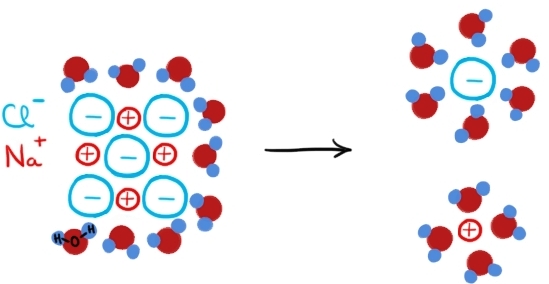
Dizolvarea unui cristal de NaCl în apă
Mai întâi moleculele de apă se infiltrează între ioni, distrugând astfel structura unui compus ionic solid. Sarcinile parțiale pozitive ale atomilor de hidrogen din moleculele de apă pot simula o sarcină pozitivă reală și pot face asta mai ales când sunt prezente mai multe molecule de apă, atrăgând astfel un anion din cristalul ionic. La fel, sarcinile parțiale negative ale atomilor de oxigen din moleculele de apă pot simula o sarcină negativă reală, atrăgând astfel un cation din cristal. Fiecare ion din cristal este înconjurat în acest fel de mai mulți dipoli de apă cu care stabilește interacții ion-dipol. Mai multe interacții ion-dipol slabe însumate ajung să depășească forța de atracție electrostatică dintre ioni, iar ionii se desprind de cristal și trec în soluție înconjurați de molecule de apă (hidratați).
Dizolvarea unui compus polar în apă:
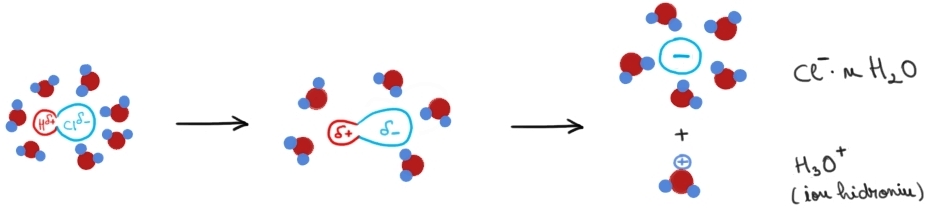
Dizolvarea unuei molecule de HCl în apă
În acest caz se formează interacții dipol-dipol între dipolii apei și moleculele polare de solut. Sub acțiunea acestor forțe intermoleculare dipol-dipol slabe, dar numeroase, molecula polară de solut trece în soluție ca moleculă hidratată. În majoritatea cazurilor, după procesul fizic de dizolvare a moleculelor polare, pot avea loc interacțiuni de natură fizică sau chiar și interacțiuni de natură chimică (ruperea legăturilor covalente, stabilirea unor noi legături covalente, formarea unor noi specii chimice în soluție).
Solubilitatea compușilor organici în apă:
- moleculele organice care conțin numai atomi de C și H (hidrocarburile) nu sunt solubile în apă;
- moleculele organice care conțin și alți atomi pe lângă C și H (de exemplu, pot conține O, N sau P) sunt solubile în apă.






