Echilibre acido-bazice. Tăria acizilor. Exponentul de aciditate - Partea I
Tag-uri
Partajeaza in Google Classroom

Transcript
aproape toate procesele chimice
care constituie ceea ce numim viață
sau majoritatea proceselor chimice
care fac tehnologia posibilă pot
fi puse în seamă activităților
două particule extrem de mici electronul
și protonul urmărind cu atenție
ceea ce se petrece în jurul nostru
conservat că majoritatea lucrurilor
se reduc la electron sau protoni
care se plimbă de la omule cula
la alta nor singur și altele ori
trăgând după ei diverse grupuri
de atomi este vorba de reacțiile
cu transfer de electroni și reacțiile
cu transfer de protoni aceste procese
atât de simple stau la baza unei
rețele norme complexul de reacții
chimice care mențin în viață sau
care fac laba această lecție să
ajungă la tine în acest capitol
ne vom concentra asupra unui singur
tip de transfer și anume transferul
protoni să continuăm a trebuit
să ne noi cunoștința cu protoni
tot protonii din orice colț al
Universului Andreea sunt exact
la fel și să bănuiește că mai toți
protonii din univers se găsesc
în interiorul atomilor mai precis
în nucleii atomilor alături de
neutroni cac2 individualitate atomilor
adică ceea ce face ca un atom să
fie de exemplu un atom de fier
sau în atomi de aur sau ceea ce
face ca un alt atom să fie un atom
de clor și tot așa este numărul
de protoni prezenți nucleul atomului
respectiv pentru chimie protonul
este de fapt nucleul unui atom
de hidrogen de obicei protonul
se notează cu simbolul hidrogen
plus ceea ce semnifică un atom
de hidrogen care pierdut singurul
său electron Așadar Ionuț distruge
este sinonim cu Proton pe scurt
subiectul acestui capitol se referă
la mâncare protonii fug de la o
moleculă și sunt capturați de o
altă moleculă aici această Proton
să vadă Așa de un nor electronic
sau se îmbracă cu o pereche de
electroni devine un atom de hidrogen
legat de molecula care la capturat
acum că știm care treaba cu personajul
principal si timpul să ne reamintim
și despre alte două personaje fără
de care nu se poate să povestim
despre transferul de protoni este
vorba despre acizi și baze știm
de la englezul Thomas laurii și
de la Danezul Johann Strauss tehnisud
este orice specie chimică care
poate dona un Proton alte molecule
iar o vază este urc spre chimică
care poate accepta un Proton aceasta
este teoria protolitica bronsted
Lauri elaborată de cei doi în 1923
Așadar un acid este un Doner de
protoni iar o bază un acceptor
de protoni la generală care are
loc la dizolvarea unui acid în
apă este următoarea regulă de ad
plus o moleculă de apă duce la
formarea unui androniu și a unui
an un aminoacid oarecare cu formula
generică a și să ne reamintim că
în notația aq se referă la faptul
că reacția este un sistem Apăs
și că toate speciile din soluții
apoase sunt specii și tratate capitol
în care vom vorbi despre acizi
și baze și transfer de protoni
Cum toate soluțiile vorbi soluției
apoase deoarece chimia acizilor
și bazelor are loc în general în
apă și o observație foarte importantă
privitoare la protoni în soluții
apoase există întotdeauna sub formă
de Ion hidroniu hidrogen plus Ionuț
este format dintr o moleculă de
apă și Union de hidrogen pentru
A simplifica lucrurile de mai multe
ori în acest capitol referit la
Ion hidroniu ca ala Union de hidrogen
și atât salvăm știi că dacă reacția
în care vom vorbi are loc în soluție
apoasă atunci când ne referim la
protoni 8 este vorba despre ionul
hidroniu și revenind la ecuația
reacției generale această reprezentare
a disocierii unui acid în apă poate
de fapt în evidență rolul pe care
îl joacă molecula de apă în molecula
polară în atragerea a protonului
din molecula acidului observăm
că ionul anis este tot ceea ce
rămâne din molecula acidului după
ce pierde protonul să ne reamintim
că a minus este de fapt baza conjugată
a acidului acidul Conjugați va
forma atunci când protonul este
transferat către baza un cuplu
achit baza conjugată conține două
specii chimice care sunt înrudite
prin donarea și acceptarea unui
singur Proton rația acestei reacții
Avem două cupluri achit baza conjugate
acestea sunt acidul h a și ionul
a minus Deci aici avem și baza
conjugată de cealaltă parte a reacției
iar celălalt cu plăci baza conjugată
este format din această moleculă
de apă Care este baza și acidul
său conjugat adică ionul de hidroniu
Așadar molecula de apă și acidul
său conjugat ionul de Haideți să
ne gândim că această relație reprezintă
de fapt competiție între cele două
baze adică între molecula de apă
și ionul a minus iar premii acestei
competiții este chiar protonul
dacă apa este o bază mai puternică
decât Ion la minus atunci echilibrul
se va deplasa spre dreapta echilibru
este deplasat foarte mult spre
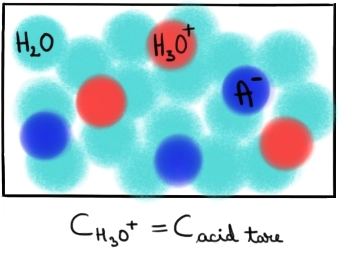
dreapta asta înseamnă că majoritatea
moleculelor de acid h mor disociat
sau vor ionizat De ce nu vă speriați
vor exista în marea majoritate
moleculele din partea dreaptă a
reacției Deci aici avem ionul A
minus și Ion hidroniu în schimb
dacă baza conjugată a minus este
mult mai puternică decât molecula
de apă ca bază atunci echilibrul
va fi deplasat foarte mult spre
stânga deci echilibrul reacției
este deplasat foarte mult spre
stânga și atuncea moleculelor de
acizi la echilibru vor fi sub forma
a adică acidul se va găsi sub forma
ne disociată vor exista în cantități
foarte mici Ion hidroniu și Ion
Amino desena vasul de reacție la
echilibru vor exista speciile din
partea stângă a ecuației reacției
în această competiție este foarte
important și ce își dorește protonul
dacă protonul este foarte atașat
de el dacă vrea să scape foarte
repede de acolo

 A-(aq) + H3O+(aq)
A-(aq) + H3O+(aq)