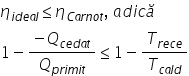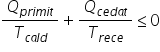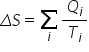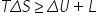Entropia şi semnificaţia ei. Principiul II al termodinamicii.
Tag-uri
Partajeaza in Google Classroom

Transcript
încet de 13-a lecție de termodinamică
vom discuta despre noțiunea de
entropie și despre principiul al
doilea al termodinamicii în lecția
precedentă de termodinamică am
discutat despre ciclul carnot care
a adus la așa numita teoremă Carlo
care spune că randamentul oricărei
mașini termice este mai mic decât
randamentul carnot al unei ipotetice
mașinii de ale bazată pe ciclu
carnot această inegalitate poate
fi scris în felul următor 1 plus
q cedat căldura cedată împărțită
la căldura primită este mai mic
sau egal decât 1 minus temperatura
sursei reci împărțită la temperatura
sursei calde întrun ciclu carnot
reamintesc că tu cedat este mai
mic decât 0 pe când q primit este
mai mare decât 0 putem scrie aceasta
inegalitate în felul următor Deci
mod Evident am simplificat 1 și
am trecut raportul de temperaturi
în partea stângă și Înmulțind această
inegalitate cu q primit împărțit
la rece obținem inegalitate echivalentă
qc dat împărțit la trec temperatura
rece plus q primit împărțit la
temperatura caldă este mai mic
sau egal cu 0 aceasta intru mașină
termică Evident la care se referă
Dar măcar nu Clau stiu sa generalizat
această inegalitate la cazul și
mai generală al mai multor procese
ce au loc între o mașină termică
spunând că în general suma rapoartelor
dintre căldura și temperatura dura
fiecărui proces din un ciclu dintr
o mașină termică este mai mică
sau egală cu 0 de asemeni a introdus
entropia Care este un parametru
de stare a cărui variație Deci
Delta l este plin definiție această
mărime suma rapoartelor dintre
căldură și temperatură pentru toate
procesele din ciclul unei mașini
termice și în consecință variația
Delta is care va fi pentru Opel
stării finale minus entropia stării
inițiale este mai mică sau egală
cu 0 o mașină termic din nou vorbim
de entropie stări pentru pentru
Opel este un parametru de stare
definită în felul următor entropia
s.ar proprietatea importantă de
a cuantifica gradul de dezordine
din sistemele termodinamice în
particular inițial în felul acesta
de introducere a în sistemele termodinamice
care sunt mașini termice Dar vom
vedea că putem extinde în cazul
general de ce facem această afirmație
Să considerăm din nou o mașină
termică mașina termică scade gradul
de dezordine adică scade intropia
dar se transformă căldura Care
este o formă de energie manifestată
prin agitația termică haotică din
gazul dinăuntrul mașinii În lucrul
mecanic efectuat Care este o mișcare
ordonată explica imediat mașina
ideală de tip karna va observa
entropia pentru că în mașina de
tip dai de ala de tip carte nouă
procesul este ciclul este reversibil
asta înseamnă că entropia finală
va fi egal cu intropia finală și
Deci voi obține 0 să revenim la
acest grad de dezordine orice mașină
termică funcționează pe un principiu
de genul următor avem un compartiment
umplut cu un gaz și un piston în
Deci Nona avem un gaz cu molecule
ce dăm o anumită sau sistemul gazul
primește o anumită energie pozitivă
sub formă de căldură căldură primită
Bineînțeles că asta va duce la
creșterea agitației termice din
interiorul sistemului Care este
o formă de energie haotică dezordonată
după cum am văzut mișcarea browniană
sau agitația termică este haotică
dezordonată dar în fază ulterioară
această energie se transformă în
lucru mecanic care duce la deplasarea
pistonului această mișcare datorată
lucrului mecanic efectuat este
o mișcare ordonată Este o formă
ordonată de energie în concluzie
entropia este parametrul care se
referă la gradul de dezordine dintru
în sistem cu anumită energie iar
variația entropiei se referă la
gradul de creștere a ordinii sau
ordinei din sistem în timp ce el
trece de la o stare la alta printr
un proces teorema karnaugh Deci
spune că pentru mașini termice
adică cel ce folosesc procese ciclice
entropia scade adică deltaic mai
mic decât 0 în procesele reale
sau mașini reale care au la bază
procese reversibile și e este egală
cu zero adică intropia se conservă
în cazul ideal al unei mașinii
de ale ce se bazează pe un proces
reversibil Bun dar ce se întâmplă
în natură toate acestea această
discuție despre entropie Până acum
a fost bazată pe mașini termice
care sunt construite de către oameni
dar să ne gândim acum Să considerăm
acum procesele termodinamice ce
au loc în natură vom vedea în curând
că în natură se întâmplă exact
invers și anume că procesele sunt
nici price și pentru acest tip
în procesele ciclice variația entropiei
este întotdeauna pozitivă sau egal
cu zero adică intropia invers crește
în natură și nu scade mai mult
în aproape întotdeauna sau întotdeauna
în natură procesele sunt și ireversibile
și în acest caz putem spune că
Delta s este mai mare decât zero
Deci în natură entropia crește
gradul de dezordine întotdeauna
crește dezordinea crește natură
și nu scade Haideți să vedem un
exemplu foarte generic și anume
celor două sisteme aflate în contact
și izolate de restul Universului
Deci care sunt în contact numai
între ele două un soir această
pereche ar fi sistem un sistem
termodinamic și mediul exterior
lui ele se află în contact și de
schimbă căldura o anumită căldură
de cantitate de căldură q între
ele pornind de la temperaturile
inițiale T1 și T2 să trasăm diagrama
temperatură timp deci pe axa verticală
avem temperatura în grade Kelvin
taxă orizontală timpul în secunde
acest tip de diagramă la studiat
când am discutat despre ecuația
calorimetrica Deci cele două sisteme
pornesc de la momentul inițial
t 0 la temperaturile de 2 și 1
și fiind în contact bineînțeles
vor schimba căldură între ele în
felul acesta stabilind un echilibru
termic la o temperatură finală
De ce avem o cedare a căldurii
q cedat este egal cu minus Q și
Deci este negativ de către corpul
cald către corpul rece cu temperatură
mai mică care va primi o aceeași
cantitate de căldură nici care
va fi plus q și pozitiv și în felul
acesta se ajunge la Starea de echilibru
termic între cele două corpuri
să scriem variația de oprire acest
caz Delta s prin definiție este
suma după ai dinții împărțit la
3 în cazul nostru putem putem scrie
ca fiind q împărțit la T1 minus
Q împărțit la T2 căldurile sunt
aceleași pentru că sistemul în
întreg întregul lui este izolat
de ce cedează corpul cad primește
corpul rece iar temperaturile în
mod Evident au următoarea ordine
te 2 este mai mare decât unul prin
definiție pentru că corpul cald
cedează energie și corpul rece
o primește În consecință putem
scrie că Delta este mai mare decât
0 dacă te 2 este mai mare decât
1 atunci și eu împărțit la t 2
este mai mic decât q împărțit la
T1 Deci Delta sa mai mari decât
0 Deci în acest caz foarte generic
pentru Opel finală este mai mare
decât pentru o perniță a întradevăr
observăm că în natură în modul
cel mai natural entropia crește
adică gradul de dezordine crește
și nu scade putem vedea acest lucru
în experiența noastră de zi cu
zi ca să exemplifici foarte simplu
Să considerăm o grămadă de cărămizi
o activitate tipică omului care
întâlnește o grămadă de cărămizi
ar fi să construiască ceva cu ele
Deci o activitate umană omul în
general omul crește gradul de ordine
al sistemului va începe să construiască
un zid Spre exemplu acest zid este
în mod Evident mai ordonat decât
în starea inițială Deci Delta s
este mai mic decât 0 omul tinde
să crească ordinea sistemelor asupra
cărora acționează invers natura
acționând asupra acestei grămezi
de cărămizi un timp îndelungat
foarte puțin probabil să construiască
ceva Mai degrabă o va transforma
prin eroziune și prin varii procese
între o grămadă de moloz sau de
de praf Deci natura Tinder să crească
intropia adică să crească nivelul
de dezordine din sistem și întradevăr
putem vedea Este evident că în
această stare finală obținută pentru
un proces natural dezordinea este
mai mare decât în starea inițială
mașina termică fiind o construcție
umană va tinde să crească și ea
ordinea adică să scadă entropia
principiul al doilea al termodinamicii
se referă la procese naturale și
spune că un proces natural adică
de tipul al doilea între două stări
de echilibru se desfășoară în sensul
care duce la creșterea entropia
a ansamblului format din sistem
și mediul exterior Deci în natură
în general întotdeauna obținem
o intropia finală mai mare decât
pentru Opa inițială adică un grad
mai mare de dezordine acest lucru
poate fi scris cu ajutorul principiului
1 al termodinamicii ca următoarea
inegalitate temperatura variația
entropiei este mai mare sau egală
decât variația energiei interne
plus lucrul mecanic va duc aminte
că principiul 1 al termodinamicii
spunea că q este egal cu Delta
u m plus el combinând cele două
principii obținem această ecuație
în care egalitatea are loc pentru
proces reversibil din nou în natură
de obicei nu avem procese reversibile
decât dacă le construim întrun
anumit fel ceea ce înseamnă iarăși
intervenția omului Deci în general
principiile 1 și 2 se pot combina
între inegalitate care spune câte
ori Delta este mai mare decât de
al tau plus real consecințele acestui
principiu al doilea al termodinamicii
și al noțiunii de entropie în general
sunt foarte importante în fizică
Spre exemplu noțiunea de timp definiția
timpului se leagă de principiul
al doilea al termodinamicii și
anume creșterea entropia iei și
principiul cauze efect Deci timpul
este ordinea proceselor care leagă
stării de tip cauză a fact prin
care entropia crește Deci sensul
de creștere al ale rochiei de o
axă o coordonata timpului de sensul
coordonatei timp Deci acest principiu
al termodinamicii de și am plecat
de la motoare termice în construcția
lui are implicații în felul final
în care este formulat mult mai
largi cu aplicabilitate mult mai
largă În