Influenţa catalizatorilor asupra vitezei de reacţie
Tag-uri
Partajeaza in Google Classroom

Transcript
lecțiile trecute am văzut cum influențează
viteza de reacție de concentrațiile
reactanților de suprafata de contact
și de temperatură de acum și care
este influența catalizatorilor
asupra vitezei de reacție catalizatorul
este o substanță ce participă la
o reacție chimică și mărește viteza
aceste reacții să nu se înțeleagă
în nici un alt fel reacții și produși
care se obțin faci are acea reacție
poate avea loc și fără prezența
unui catalizator deși ar dura mult
mai mult De asemenea catalizatorul
nu suferă nici o schimbare chimică
netă în timpul reacției de catalizatori
nu se consumă gay pot fi reciclate
deși în ceea ce privește produșii
de reacție este același modul de
funcționare al catalizatorilor
este oferirea unui mecanism de
reacție alternativ Iar acest mecanismele
terminații presupune o stare de
tranziție diferită și activare
mai scăzută cu alte cuvinte catalizatorul
modifică mecanismul unei reacții
chimice iar reacția catalizată
va decurge în mai multe etape fiecare
etapă se caracterizează prin reactivare
mai mică decât energia de activare
a reacției ne catalizate consecința
s mai multe particule Oradea energia
de activare necesară pentru a da
ciocnire și caise iar mai multe
certificate înseamnă o viteză de
reacție mai mare Haideți să privim
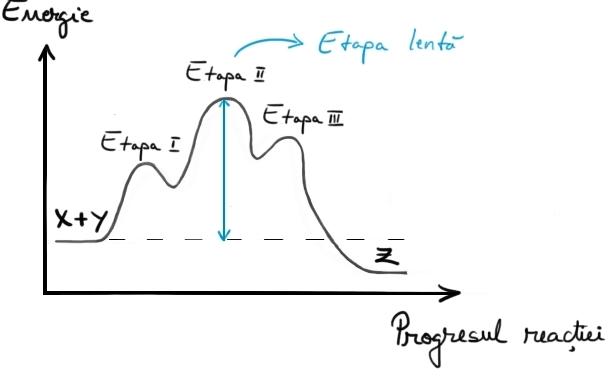
această diagramă energetică pentru
o reacție Generală de forma x y
formează produsul pentru această
reacție ne catalizată avem energia
de activare ea pe prezentată cu
gri pe diagramă atunci când se
desfășoară în prezența unui catalizator
second ichiban reacții ar putea
fi acesta avem o primă etapă care
se desfășoară mai lent după cum
vedem și pe grafic în țară este
mai mică decât energia reacției
ne catalizate are loc și eu a doua
etapă care decurge mai rapid vedem
că energia de activare necesară
notată cu ăia doi este cu mult
mai mică variația energiei potențiale
pentru reacția catalizată este
redată cu albastru pe diagramă
iar totalul yadoya 1a reacții catalizate
este mai mic decât ea adică energia
de activare a reacției ne catalizate
din acest vedem că în timpul ciclului
catalitic catalizatorul se transformă
în diferit intermediari dar la
sfârșitul ciclului se regăsește
în forma inițială foarte multe
reacții au un mecanici complex
care are mai multe etape indiferent
că se folosește sau nu catalizatorul
într o relație care are De exemplu
trei etape să zicem că a doua a
este etapa lentă cea care necesită
energia de activare cea mai mare
viteza unei astfel de reacții care
decurge în mai multe etape coincide
cu viteza etapei lente aceasta
este etapa determinantă de viteză
nu contează cât de repede are loc
prima etapă reacția nu va evolua
până când nu trece de etapele prima
este că nu ne putem permite întotdeauna
să așteptăm după această etapă
Uneori trebuie puțină pizza de
la spate și aici intervin catalizatori
care vor micșora energia de activare
astfel mărind viteza de reacție
călătorii pot lua multe forme diferite
o altă substanță chimică pe care
o adăugăm în vasul de reacție o
bucată de metal care intră în contact
cu reactanți stăpâna vrea chiar
și forma gazoasă aproape toate
dintre din care le produse industriale
sunt obținute prin reacții catalitice
de acele catalitice fiind Deci
reacțiile care au loc în prezența
catalizatorului una dintre cele
mai importante clase de catalizator
sunt enzimele din organismele vii
fără enzime majoritatea proceselor
chimice din organismul nostru care
trebuie să aibă loc în continuă
pentru ca noi să fim în viață Deci
fără enzime procesele care ne menținem
în via mult pentru eficiente și
simplu nu am putea supraviețui
fără catalizatorii prezintă mai
multe proprietare cele mai importante
sunt activitatea catalitică Și
selectivitatea am discutat câte
puțin despre fiecare activitate
a catalitică ce măsoară prin numărul
de molecule de reactanți care se
transformă în unitatea de timp
pe unitatea de suprafață de catalizator
pentru că față de contact Este
foarte importantă catalizatorii
sunt preparați astfel încât prefața
de contact cu reactanți să fie
cât mai mare activitatea catalitică
scade În cât timp scade acest lucru
depinde de particularitățile fiecărei
reacții catalitice în parte însă
activitatea este influențată de
Promotor și otrăvuri Haideți să
vedem acum și ce sunt aceste substanțe
promotorii sunt substanțe care
îmbunătățesc proprietățile catalitice
de exemplu urmăresc activitatea
catalitică a catalizatorilor în
să iei importantă reținut că promotorii
nu aude ifică viteza de reacție
în absența catalizatorilor un exemplu
este folosire Aluminei adică a
oxidului de aluminiu în prepararea
catalizatorului pentru sinteza
amoniacului fierul este catalizatorul
pentru obținerea amoniacului însă
în condițiile de sinteză activează
foarte rapid prin adăugarea a luminii
activitatea catalitică se dublează
iar în plus catalizatorul rămâne
activ câteva luni Pe de altă parte
există și otrăvuri acestea sunt
substanțe care diminuează sau chiar
leagă activitatea catalitică de
exemplu Cătălina torul de fier
pentru sinteza amoniacului se otrăvește
când amestecul de reacție ajunge
să conțină urme de monoxid de carbon
catalizatorul își poate recăpăta
activitatea când se elimină monoxidul
de carbon din fluxul de gaze și
cea de a doua proprietate importantă
a catalizatorilor este selectivitatea
aceasta Reprezintă capacitatea
unui catalizator de a favoriza
o anumită din mai multe posibile
adică capacitatea de a dirija transformarea
chimică preferențial e spre formarea
unui anume produs de reacție acolo
unde să am mai multe produse astăzi
mai devreme că avem catalizator
de mai multe tipuri și forme în
funcție de starea de agregare a
catalizatorilor dar și le actanți
lor există mai multe tipuri de
reacții catalitice avem reacții
catalitice omogene în acest caz
se actanții și catalizatorul formează
o singură fază de cele mai multe
ori o fază lichidă în catalizatorul
omogeni este dizolvat în mediul
de reacții există foarte multe
substanțe care nu mediul lichid
pot acționa drept catalizatori
omogen de exemplu acizi bazele
Ionești draxin sau hidroniu dar
mai ales combinațiile complexe
ale metalelor tranziționale în
reacțiile catalitice eterogene
catalizatorul și reactantii nu
aparțin aceleiași faze viața chimică
are lumea interfața formată de
fazele aflate în contact Așadar
în cataliza eterogenă sunt posibile
tot felul de combinații de stări
de agregare ale catalizatorilor
și ale reactanților Dar cel mai
mare interes practic reprezintă
reacții amestecurilor de gaze sau
lichide catalizator Sony în industria
este utilizează foarte mult cataliza
eterogenă în special pentru că
materialele stolle de utilitate
de catalizatori Au rezistența termică
ridicată iar produșii de reacție
se pot separa de catalizator fără
a fi nevoie de tapet suplimentare
de prelucrare în general catalizatorii
au nevoie de un suport Sony pe
care să fie de pui suportul pe
care este depus un catalizator
joacă un rol foarte important în
reacția catalitică acesta poate
îmbunătăți calitățile mecanice
Ale catalizatorului ne putem imagina
un suport Catalina fiind un material
solid poros care captează molecule
de catalizator în polițistă și
le ține acolo fixate le Sandule
totuși îndeajuns de mult pa cât
să se poată forma și interfața
de la care are loc reacția chimică
drept suport pentru catalizatori
se utilizează mai multe materiale
printre care argint azi best cărbune
activ piatră ponce și oxid de aluminiu
sau alumină de care vorbeam mai
devreme și un al treilea tip de
reacții catalitice sunt reacțiile
enzimatice când catalizatorul este
o enzimă după cum am mai zis toate
organismele vii Depinde în zile
însă există și multe procese industriale
în care tot enzimele sunt catalizatori
mai există o clasă de compuși pe
care trebuie să o cunoaștem atunci
când vorbim de catalizator este
vorba de iubitori iubitorii au
capacitatea de a micșora viteza
reacțiilor chimice acționând asupra
reactanților Deci să nu confundăm
iubitorii cu otrăvurile care acționează
asupra catalizatorului dacă ne
gândim la o reacție chimică precum
coroziunea Clara vrea să încetinim
cât mai mult procesul prin care
se distrug Metalele în funcție
de metale și de condițiile de care
trebuie să le protejăm se pot folosi
fie iubitorii anorganici Așadar
catalizator este un substanțe care
măresc viteza de reacție iar inhibitorii
micșorează viteza de reacție pe
lângă importanța lor practică în
industrie pe lângă importanța lor
practică în industrie catalizatori
joacă un rol din ce în ce mai important
pentru secția mediului asta de
varice prin reacții catalitice
se pot distruge agenți poluanți
sau se pot dezvolta procese industriale
noi mai puțin poluante