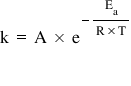Influenţa suprafeţei de contact şi a temperaturii asupra vitezei de reacţie
Tag-uri
Partajeaza in Google Classroom

Transcript
Ecuația stoechiometrica a unei
reacții chimice descrie relațiile
cantitative dintre participanții
la reacții și cantitățile de produși
care se pot forma de magie Na acum
moleculele se ciocnesc și se rearanjează
pentru a forma produșii prin tot
felul de mecanisme mai mult sau
mai puțin complexe însă nu putem
ști cât de repede are loc reacția
sau dacă nu cumva are loc atât
de încet încât imposibil de utilizat
în practică obține Muscel de informații
extrem de utile de altfel despre
mecanismele de reacție și despre
vitezele de reacții numai studii
în cinetică a unei reacții chimice
să ne reamintim câteva dintre factorii
care influențează viteza unei reacții
chimice avem concentrația reactanților
suprafața de contact temperatura
și prezența catalizatorilor studiind
vitezele de reacție și fabricare
Descoperă cum pot controla a desfășurare
reacțiilor chimice pentru a ajunge
la un rezultat De care De obicei
beneficiem cu toți lecția trecută
am vorbit despre influența concentrațiilor
reactanților asupra vitezei de
reacție și am văzut că în general
cu cât aceste concentrație sunt
mai ridicate cu atât viteza reacției
crește și ea iar această dependență
a vitezei de concentrația de actanți
lor este exprimată prin legea vitezei
de reacție despre care am discutat
lecția trecută acum în ceea ce
privește influență a suprafeței
de contact asupra vitezei de reacție
Haideți să facem un mic exercițiu
de imaginație să zicem că vrem
să amestecăm sare cu zahăr acum
nu știu de ce am vrea să facem
asta cel mai probabil pentru gras
rețetă în fine ideea este că trebuie
să ne dăm seama în ce situație
aceste 23 mai repede când amândoi
compuși se află în stare solidă
când unul este O lins și celelalte
sub formă de soluție sau atunci
când avem ambii compuși tu pe urmă
de soluție E logic că în ultimul
caz când sunt sub formă de soluție
sarea și zahărul se vor amesteca
cel mai repede acest lucru este
valabil și în cazul reacțiilor
chimice mai complexă redistribuire
a legăturilor chimice adică ruperea
vechilor legături formarea unor
noi legături are loc în momentul
în care particulele reactant este
ciocnesc șansele ca aceste particule
să se ciocnească depind de gradul
lor de libertate de liber se pot
mișca în vasul de reacții întruna
bisexuali viteza de reacție este
foarte mică particulele sunt cu
mult mai stabile decât în celelalte
stări de agregare astfel reacția
este localizată doar la nivelul
punctelor de contact din de particule
ea Nu are loc în toată masa sistemului
Așadar reacția are loc cu viteză
mai mare când reactanți se găsesc
în soluție acest caz gradul de
libertate de gradul de dispersie
a particulelor este mai mare particulele
au în diametru mai mic iar a astfel
se stabilesc mult mai multe puncte
de contact între ele este că și
viteza de reacție este mult mai
mare așa dar viteza de reacție
este mai mare în fază lichidă decât
în pază solida iar o suprafață
mare de contact dintre reactanți
înseamnă o viteză de reacție mărită
motoarele mașinilor se folosesc
de suprafata de contact pentru
a mări viteza de reacție benzina
injectat în fiecare cilindru al
motorului Unde combustiei are loc
la aprinderea unei scântei de la
bujie secretul stă în faptul că
benzina injectată sub forma unor
picături microscopice deoarece
această formă are o suprafață de
contact cu mult mai mare în consecință
ar de mult mai repede decât dacă
ar fi alimentat în cilindru sub
forma unui cerc de benzină continua
Haideți să vedem și care este influența
temperaturii asupra vitezei de
reacție creșterea temperaturii
oricărui sistem dus la creșterea
energiei cinetice medii a particulelor
din acest sistem particulele se
mișcă din ce în ce mai repede Deci
crește agitația termică și vor
exista mai multe ciocnire și caise
în unitatea de timp Ba mai mult
datorită creșterii energiei cinetice
crește și energia pe care particulele
opuse de atunci când se ciocnesc
acestui Factor creștere a numărului
de ciocnire fie ca a c și creșterea
energiei particulelor la ciocnire
duc la O mărire a vitezei Așadar
vedem că viteza tuturor reacțiilor
chimice crește odată cu creșterea
temperaturii bineînțeles este valabilă
și relația inversă viteza reacțiilor
chimice descrește Pe măsură ce
crește temperatura sistemului funcția
lor de fapt frigiderele sau orice
alte căi prin care depozităm alimentele
la rece nu faca ceva decât să întârzie
viteza de creștere a bacteriilor
din alimente prin depozitarea la
temperaturi scăzute ca de viteză
alea biochimice care permit reproducere
a bacteriilor în expresia a vitezei
de reacție factorul Care este de
temperatură este constanta de viteză
ca amintim de Alexia trecută că
legea vitezei unui prin care se
exprimă dependența vitezei de reacție
de concentrația relaxați lor are
în componența sa și această constantă
de viteză ca Pe măsură ce temperatura
se mărește ce mărește și valoarea
lui Codin legea vitezei prin anii
1890 se cunoștea deja faptul că
temperaturile ridicate măriți viteza
reacțiilor oamenii care Na mai
întâlnit și cu altă ocazie acum
vinil două concepte pentru una
din cele mai importante relații
din Sinaia fizică relația lui areni
re de dependența constantei de
viteză de temperatură cele două
concepte pe care le combinați chimistul
suedez în această relație sunt
energia de activare și legea de
distribuție a lui boltzmann vorbind
despre el imediat a este un factor
prinț iali care e o constantă specifică
fiecărei reacții pe el îl cunoaștem
de la matematică este o constantă
iar Erica la o putere i se numește
funcția exponențială a știind că
este energia de activare este constanta
gazelor ideea Iar te reprezintă
temperatura absolută produsul erori
se reprezintă energia cinetică
medie a unui Mol de gaz pentru
o reacție care implică ciocnirea
a două molecule de activare reprezintă
energia cinetică minimă necesară
pe care moleculele reactante trebuie
să posteze pentru a putea forma
a produșii de reacție Spre exemplu
în cazul unei reacții în față gazoasă
au loc numeroase ciocniri În fiecare
secundă însă numai o mică proporție
dintre aceste ciocniri sunt suficiente
pentru a duce la o reacție lecția
de ciocniri care au loc cu energie
cinetică mai mare decât energia
de activare ea este dată de distribuția
boltzmann Drept e la puterea minus
ea e supra a rorty astfel putem
interpreta factorul exponențial
din relația lui arrhenius drept
fracția de ciocniri care au suficiente
energie cinetică pentru a aduce
la reacție sau mai putem spune
că este probabilitatea ca o ciocnire
oarecare să fie eficientă pastorul
prespune țial a este o măsură a
vitezei la care ciocnirile au loc
fără să țină cont de energia lor
Deci a reprezintă de fapt numărul
total de ciocnit pe secundă indiferent
dacă sunt eficiente sau nu Și așa
să vedem că produsul dintre faptului
a fi factorul exponențiali e la
puterea a minus e asupra erori
se adică Constanța de viteză ca
reprezintă de fapt Viteza ciocnirilor
se cace dintre particulele reactante
aceea chimică are la temperaturi
diferite și valori diferite ale
Constanței de viteză relația lui
arrhenius te ajută să determinăm
energia de activare a unei reacții
pentru asta trebuie să cunoaștem
valorile a doua constantă de viteză
pe care le luăm ca unul și ca doi
corespunzătoare a două temperaturi
diferite pe unul și pe 2 si 2 este
mai mare decât 1 și astfel avem
expresiile constantelor de viteză
la acele două temperaturi T1 și
T2 raportăm cele două constante
Deci avem ca doi supra ca unul
egal cu acest raport care în continuare
este egal cu el o putere cam complicată
dar putem da un factor comun așa
dar am obținut această expresie
pe care o logaritm mă și după foarte
puțină matematică și cunoștințe
de bază despre logaritmul natural
poți No matematică și cunoștințe
de bază despre logaritmul natural
obținem următoarea relație și aceasta
este expresia din care putem calcula
ai energia de activare de energia
de activare este egală cu această
expresie Ciao dacă o rearanjat
puțin cu aceasta pare o Relație
complicată însă lucrurile sunt
de fac foarte simple atunci când
avem valorile celor două constante
de viteză și a celor două temperaturi
determina energia de activare și
prin metoda grafică pentru asta
trebuie să cunoaștem la fel ca
și în cazul precedent valorile
constantei la diferite temperaturi
Așadar pornind de la ecuația lui
arrhenius pe care o logaritmam
și obținem următoarea relație logaritm
de ca este egal cu logaritm din
a minor gea de activare supra Constanța
gazelor ori 1 pe această relație
are forma ecuației dreptei xy egal
a x dacă nu ies clar logaritmica
cu y și care este influența catalizatorilor
asupra vitezei de reacție