Proprietăţile apei
Partajeaza in Google Classroom

Transcript
Apa este fluidul cel mai remarcabil
care există pe pământ fără apă
niciuna dintre reacțiile care ne
menține în viață nu ar mai putea
avea loc așa că merită ceva mai
multă atenție deși este cel mai
bun Dan compus trimit de pe pământ
și esențiale pentru viață proprietățile
remarcabile ale apei sunt parcă
în contradicție cu structura etnică
atât de simplu după aproape toată
lumea fiecare moleculă de apă conține
un singur atom de oxigen și doi
atomi de hidrogen atomii de hidrogen
sunt Uniți prin câte o legătură
covalentă simplă de atomul de oxigen
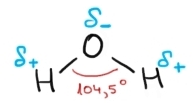
cele două legături formează un
unghi de 100 4 G oxigenul este după
cum am mai discutat puternic electronegativ
De ce trage cel mai puternic electronic
din legăturile covalente astfel
influențând geometrie a moleculei
și toate celelalte proprietăți
ale apei dacă geometria moleculei
ar fi fost aceasta adică ar fi
fost o moleculă simetrică polaritatea
celor două legături sarfi anula
Reciproc iar molecula de apă nu
ar mai fi fost polară și în consecință
nu ar mai fi avut toate proprietățile
care fac din apă un fluier de esențial
apare proprietăți diferite față
de celelalte substanțe cu structuri
similare în comportamentul normal
și Oare cam ciudat al apei dar
restul ordinar de important Omule
cu LED de apă are 18 G pe Mol și
este doar cu puțin mai grea față
de o moleculă de Metan care are
16 g pe Mol sau față de o moleculă
de amoniac care are Masa moleculară
de 17 G pe Mol și cu toate astea
deși metanol și amoniacul sunt
gaze la temperatura camerei aceeași
temperatură apa este în stare lichidă
de asemenea Apa este aproape unică
în ceea ce privește forma a solidă
adică gheața Care este mai puțin
densă decât formă lichidă astfel
încât gheața plutește pe apă formele
solid ale altor substanțe nu ar
plăti în formele lor lichide Deci
densitatea gheții care egală cu
0 17 G pe mililitru este mai mică
decât densitatea apei Care este
egală cu 1 g pe mililitru de ce
aisbergurile plutesc pe apă asta
adus la scufundarea titanicului
Poate ar fi fost mai bine ca aceasta
să fie mai grea decât apa sau oare
să fi fost mai bine această densitate
mai mică a gheții este de OSB de
sub gheață se găsește un strat
de apă care face posibilă viață
acvatică acest lucru e foarte important
pentru existența ecosistemului
în forma în care există o altă
proprietate foarte importantă este
aceea că apa e un solvent de excelenta
poate dizolva un număr mare de
gaze și de Sorin o consecință a
faptului că apa e un bun solvent
E aceea că apa e un mediu comun
pentru reacțiile chimice odată
ce substanțele participante la
reacție chimică sau dizolvat în
apă moleculele lor se pot mișca
liber și pot întâlni altei substanțe
dizolvate cu care pot reacționa
oceanele Spre exemplu sunt niște
mari magazii de materie dizolvată
incluzând până și gazele din atmosferă
substanțe atât de diferite între
precum sarea care e un compus ionic
și zahărul care e un compus molecular
se dizolvă rapid în apă puterea
apei de a dizolva compuși ionici
vine tot de la prezența sarcinilor
electrice parțiale atomilor care
formează moleculele de apă Pe de
altă parte substanțele moleculare
precum zahărul se dizolvă atât
de ușor în apă deoarece moleculele
de zahăr conțin grupe ohashi care
formează legături drojin cu moleculele
de apă după cum ai discutat deja
în lecția despre legătura covalentă
una din proprietățile cele mai
importante ale moleculei de apă
este felul în care sarcina electrică
a moleculei este distribuită deși
per total molecula de apă este
neutră din punct de vedere electric
sarcina al că nu este distribuită
uniform deoarece oxigenul are o
electronegativitate mai mare va
Trage mai puternic pe el electronii
din legăturile covalente căpătând
astfel o sarcină parțial negativă
atomi de hidrogen capătă o sarcină
parțial pozitivă a fiind atomi
care pun câte un electron în comun
cu oxigenul dar totuși lasă atomul
de oxigen să se bucure mai mult
de electroni ca rezultat al acestei
atracții dintre sarcinile parțiale
de semn contrar omule cură de apă
se poate lega Da dar alte molecule
de apă vecine care la rândul lor
saver legat de alte molecule de
apă și tot așa după cum am vorbit
lecția trecută este vorba de Forțele
de atracție intermoleculare și
anume de legăturile de hidrogen
care se formează între moleculele
vecine de apă înghesuială de molecule
de apă care se mișcă întruna formate
prin legături de hidrogen constituie
fluidului care ne atât de familiar
adică apa și comportamente este
opus cu forta mentului pe care
îl are metanul molecula de Metin
are sarcini parțiale mai slabe
adică legături covalente mai puțin
polarizate deoarece nucleul atomului
de carbon are o sarcină mai slabă
decât nucleul unui atom de oxigen
să ne reamintim că sarcina nucleară
se notează cu plus de sarcină carbonului
plus 6 este mai mică decât sarcină
plus 8 oxigenului în plus sarcina
electrică parțială a atomului de
carbon e bine ascunsă în spatele
celor patru atomi de hidrogen În
consecință în moleculele de Metan
se leagă unele de altele foarte
foarte slab astfel că la temperatura
camerei metanul este un gaz format
din molecule independente foarte
separate care se mișcă independent
de capul lor să luăm acum mulțimea
de molecule care constituie apa
în formă lichidă acesta este tipul
de aranjamente pe care ar trebui
să le avem în minte atunci când
ne gândim la lichidul porc aceasta
imagine este ca un stop cadru dintre
un pic moleculele sunt de fapt
o mișcare continuă rostogolim de
să ieși mișcând dusei întruna dintre
o parte în alta a peste moleculele
de când apa îngheață la această
mișcare se potoleste iar moleculele
se așează între un aranjament foarte
ordona a și staționar ca în această
figură în această stare solidă
de gheață între moleculele apei
se stabilește un număr maxim de
legături de hidrogen fiecare moleculă
este încă atrasă de moleculele
vecine datorită atracției dintre
sarcină partiali opuse dar acum
il adoptă o structură deschisă
asemănătoare cu un fagure de miere
Deci când apa îngheață moleculele
de apă stau liniștită pe loc fără
să se mai miște una peste alta
formând un aranjamente hexagonal
caracteristic și fulgilor de zăpadă
această structură foarte organizată
a cristalului de gheață afinată
cu mai multe goluri este motivul
densității mai mici a gheții topire
a reprezintă prăbușirea acestei
structuri mișcarea de tute vino
amole culelor devine din ce în
ce mai energică Pe măsură ce temperatura
crește astfel încât moleculele
încep să se miște iarăși din una
peste alta iar structura organizată
se prăbușește o altă anomalia apei
e reprezentată de punctul de fierbere
care știm cu toții că este 100
de g în acest tabel sunt prezentate
valorile punctelor de fierbere
pentru hidrurile elementelor din
grupa 16 comparând datele în acceptul
că punctul de fierbere al apei
este anormal de ridicat comparativ
cu cel al celorlalte hidruri din
serie acest comportament se datorează
formării legăturilor de hidrogen
între moleculele de apă legăturile
de hidrogen fiind cu mult mai puternice
decât interactii ledi polipol care
se exercită între moleculele de
hidrogen sulfurat și între moleculele
hiturilor de seleniu și de Telekom
10 în această lecție că apa e un
compus chimic extraordinar datorită
geometriei moleculei a sarcinilor
parțiale ale atomilor sarcini apărute
din cauza a legăturilor covalente
polare dintre atomul de oxigen
și cei doi atomi de hidrogen dar
și datorită legăturilor de hidrogen
dintre moleculele de apă si cu
ocazia asta nea mai convinși că
e foarte important Să înțelegem
legăturile din interiorul unei
molecule dar și legăturile dintre
moleculele unei substanțe pentru
că de acolo rezultă proprietățile
și comportamentul chimiei ca al
acestora