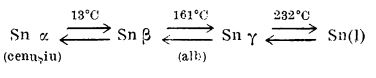Staniul este un metal cunoscut din timpurile cele mai vechi; la noi este cunoscut și sub denumirea de cositor. Bronzul, aliajul său cu cuprul, a dat numele uneia dintre primele epoci ale culturii omenești.
Răspândire în natură. Staniul se găsește în natură mai ales sub formă de
casiterit (dioxid de staniu, SnO
2) în rocile de granit, alături de cuarț, minereuri de fier, cupru și plumb.
Zăcăminte importante de minereuri de staniu se găsesc în Mexic, China, Siberia, Indonezia, Malaezia, Bolivia, Australia, etc. Cel mai mare producător de staniu din lume este Congo (Kinshasa).
Preparare. Pentru extragerea staniului, casiteritul trebuie în prealabil supus unei operații de îmbogățire, până când concentrația în SnO
2 crește până la 60%. Concentratul se încălzește apoi în cuptoare cu cărbune și fondant. Reacția de reducere este, în principiu, următoarea:
SnO2 + 2C = Sn + 2CO
În urma topirii reducătoare a concentratelor de staniu rezultă un staniu brut, care conține și alte metale, și o zgură bogată în staniu. Staniul brut, care conține și alte metale, și o zgură bogată în spațiu. Staniul brut este supus rafinării, care se poate face după diferite procedee pirometalurgice și, în anumite cazuri, prin electroliză. Zgurile, care mai pot conține până la 25% Sn, sunt și ele prelucrate în scopul extragerii metalului.
Prelucrarea zgurilor, care sunt formate în cea mai mare parte din silicat de staniu, SnSiO3, se poate face fie prin metoda reducerii, adică topire cu cărbune și var:
SnSiO3 + CaO + C = Sn + CaSiO3 + CO
fie prin metoda precipitării, adică topire cu deșeuri de fier și cărbune:
SnSiO3 + Fe = FeSiO3 + Sn
SnO2 + 2C = Sn + 2CO
Staniul, fiind un metal foarte căutat, în multe țări lipsite de zăcăminte naturale el este recuperat din deșeurile care îl conțin (de exemplu cutiile vechi de conserve, care sunt confecționate din tablă de fier cositorită). Recuperarea staniului se face fie pe cale electrolitică, fie prin tratare cu clor, când se obține tetraclorura de staniu, SnCl4, în stare de vapori.
Proprietăți fizice. Staniul este un metal alb, cu strălucire argintie. Frecat între degete lasă un miros neplăcut. Dintre toate metalele de uz comun, staniul are cea mai joasă temperatură de topire (231,8°C). Punctul lui de fierbere este foarte înalt (2362°C); staniul se volatilizează însă de la 1200°C.
Staniul se prezintă sub formă de mai multe modificații alotropice. Între 18 și 161°C are o structură cristalină tetragonală și densitatea 7,3 (
staniul 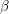
). Peste 161°C are structura cristalină rombică și densitatea 6,6 (
staniul 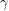
). Sub 13°C, staniul devine pulverulent, de culoare cenușie, cu densitatea 5,7 (
staniul cenușiu sau
staniul 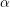
):
Transformările sunt reversibile.
Faptul că, uneori, când sunt menținute mai mult timp la temperaturi scăzute, obiectele de staniu se acoperă pe alocuri sau în întregime cu o pulbere cenușie - fenomen numit “ciuma staniului” - se datorează tocmai transformării staniului obișnuit în staniu cenușiu. Deci, numai datorită unei transformări în structura metalului și nu unui atac din exterior se explică fărâmițarea cu timpul a obiectelor de staniu. Tendința de a se transforma în staniu cenușiu este cu atât mai mare, cu cât temperatura este mai joasă de 13,2°C.
Structura cristalină a staniului cenușiu este similară diamantului, însă cu constanta de rețea mai mare.
Bastonașele de staniu, când sunt îndoite, produc un zgomot, “strigătul staniului’ datorită ruperii cristalelor metalului.
Staniul este foarte ductil maleabil; el poate fi tras în fire și foi subțiri.
Proprietăți chimice. Staniul este stabil la aer. Încălzit la 200°C se oxidează la suprafață; la temperatura mai înaltă se transformă în dioxid de staniu.
Staniul se poate combina cu hidrogenul formând hidrura de staniu, SnH4, o combinație care s-a putut separa și menține un timp oarecare în vase închise. De asemenea se combină cu halogenii, sulful, seleniul, telurul, fosforul; cu azotul se combină numai indirect.
Staniul este atacat încet de acizii diluați; cu acidul clorhidric formează clorura stanoasă:
Sn + 2HCl = SnCl2 + H2
Cu acidul azotic concentrat reacționează energic formând formând dioxidul de staniu hidratat. Cu acidul sulfuric concentrat reacționează mai lent, cu dezvoltare de SO2:
Sn + 2H2SO4 = SnSO4 + SO2 + 2H2O
Cu hidroxizii alcalini, la fierbere, formează hidroxostanați (IV), numiți pe scurt stanați:
Sn + 4H2O + 2NaOH = Na2[Sn(OH)6] + 2H2
Cu alte metale formează aliaje.
Utilizare. Staniul, nefiind toxic, se întrebuința înainte pentru confecționarea diferitelor vase și cupe pentru alimente și băuturi. Astăzi, cele mai mari cantități de staniu sunt folosite la cositorirea tablei necesare cutiilor de conserve și a unor acoperișuri.
Staniul se mai folosește la confecționarea unor vase de măsură, aparate industriale (retorte, serpentine, refrigerente) și la cositorirea vaselor de aramă. În industria alimentară se folosesc foițe de staniu pentru împachetat alimente (staniol). Staniul este foarte mult întrebuințat pentru metalelor. În acest caz se aliază cu plumbul.
Aliaje de staniu. Plumbul, cu care staniul se poate alia în orice proporție, îi conferă acestuia duritate și rezistență. Efect similar are cadmiul, cuprul, antimoniul și bismutul.
Dintre toate aliajele staniului, cel mai important este aliajul de cositor pentru lipit, care conține 20-80% plumb. Compozițiile pentru lagăre, numite și aliaje antifricțiune, mai conțin ca adaosuri, antimoniu și cupru. Aliaje de Sn-Cu se numesc bronzuri.
Staniul poate forma atât compuși de staniu (IV), în care are funcție de metal tetravalent (formează cationi Sn4+), dar mai ales funcție de nemetal (formează anioni), precum și compuși de staniu (II), în care are de obicei funcție de metal bivalent (formează cationi Sn2+). De asemenea are tendința de a forma complecși în care intră în componență anionul complex.
Ionii Sn2+ și Sn4+ sunt incolori în soluție; tot așa, și ionii complecși. Numai unele combinații ale staniului (II) sunt colorate (de exemplu SnS, care este brună, sau SnS2, care este galbenă).
Combinațiile de staniu (II) au tendința de a trece în combinații de staniu (IV), ceea ce arată caracterul lor reducător.
Cu oxigenul staniul formează doi oxizi: oxidul de staniu, SnO, și dioxidul de staniul, SnO2.
Oxidul de staniu, adică
oxidul de staniu (II) sau
oxidul stanos, SnO, este o pulbere brună sau cristale albastre-negre. El rezultă prin deshidratarea la 100°C a oxigenului de staniu (II) hidratat, SnO·
xH
2O. Acesta este un precipitat coloidal, alb, care se obține când se tratează soluția unei sări de Sn
2+ cu un hidroxid alcalin. În mod obișnuit este considerat hidroxid și notat Sn(OH)
2. El reacționează cu acizii tari formând săruri ale staniului (II), ca de exemplu:
Sn(OH)2 + 2HCl = SnCl2 + 2H2O
iar cu hidroxizii alcalini formează hidroxostanați, ca de exemplu:
Sn(OH)2 + NaOH = Na[Sn(OH)3]
Prin urmare are caracter amfoter.
Din cauza tendinței de a trece în combinații ale staniului (IV), hidroxidul de staniu (II) și soluțiile de hidroxostanați (II) au putere reducătoare, proprietate pe care se bazează folosirea lor în imprimeria și vopsitoria textilă.
Dioxidul de staniu, adică
oxidul de staniu (IV) sau
oxidul stanic, SnO
2, este o pulbere albă, insolubilă în apă, acizi și baze. Industrial, se obține prin trecerea unui curent de aer peste staniu puternic încălzit.
Prin încălzire în curent de hidrogen trece în staniu metalic; prin încălzire în curent de clor formează tetraclorura de staniu.
Dioxidul de staniu este o anhidridă. Prin topire cu un hidroxid alcalin se obține o sare ușor solubilă în apă, hidroxostanatul (IV) de sodiu:
SnO2 + 2NaOH + 2H2O = Na2[Sn(OH)6]
Dioxidul de staniuse folosește ca adaos la fabricarea sticlelor, a emailurilor și smalțurilor, cărora le imprimă o culoare albă opacă. Dioxidul de staniu natural, casiteritul, este materia primă din care se extrage staniul.
Dioxidul de staniu hidratat obținut prin hidroliza la temperatură scăzută a unei sări de staniu (IV) în soluție (oxidul
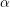
) este ușor solubil în acizi sau baze, în timp ce dioxidul de staniu obținut prin hidroliza la temperatură ridicată sau prin acțiunea acidului azoti asupra metalului (oxidul
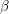
) este aproape inert. Studii cu raze X au arătat că ambele forme au aceeași structură, diferența de reactivitate fiind atribuită diferențelor între mărimea particulelor, naturii suprafețelor particulelor etc.
Stanații, uzual formulați ca metastanați, MI2SnO·3H2O, sunt în realitate hidroxostanați. Stanatul de potasiu, K2[Sn(OH)6], este izomorf cu plumbatul de potasiu, K2[Pb(OH)6], conținând șase ioni OH- dispuși octaedric în jurul atomului central.
Dintre sărurile de staniu, mai importante sunt clorurile și sulfura de staniu (IV).
Diclorura de staniu, adică
clorura de staniu (II) sau
clorura stanoasă, SnCl
2, este o masă albă lucioasă care se obține prin tratarea staniului cu acid clorhidric gazos. Este ușor solubilă în apă, alcool, eter și alți dizolvanți organici; din soluția apoasă cristalizează sub formă de hidratați cristalini, SnCl
2·2H
2O.
Clorura stanoasă este un reducător puternic; ea reduce sărurile ferice la săruri feroase, permanganații la săruri manganoase, cromații la săruri cromice etc.:
3SnCl2 + K2Cr2O7 + 14HCl = 3SnCl4 + 2CrCl3 + 7H2O + 2KCl
Astfel, dacă la o cantitate mică de soluție clorhidrică de clorură stanoasă se adaugă, picurând, o soluție de dicromat (sau cromat) de potasiu, soluția devine verde din cauza reducerii cromului de la numărul de oxidare +6 (în dicromat), la numărul de oxidare +3 (în clorura cromică).
De asemenea reduce unele metale din sărurile lor în soluție, de exemplu aurul sau argintul.
Dacă într-o soluție de clorură stanoasă (sau altă sare stanoasă) se adaugă câteva picături de clorură de aur, apare o colorație purpurie (“purpura lui Cassius”). În urma reacției:
3Sn2+ + 2Au3+ + 6H2O = 2Au + 3SnO2 + 12H+
se formează dioxid de staniu care rămâne în soluție în formă coloidală și adsoarbe aurul, care și el se găsește în soluție ca un sol de culoare purpurie. Prin urmare, “purpura lui Cassius” rezultă prin adsorbția a doi coloizi. Ea este utilizată ca pigment în industria porțelanului. Reacția este foarte sensibilă și poate fi utilizată pentru identificarea sărurilor de staniu (II).
Tetraclorura de staniu, adică
clorura de staniu (IV) sau
clorura stanică, SnCl
4, se obține în industrie prin tratare cu clor a deșeurilor de tablă cositorită. Este un lichid incolor care fumegă la aer și se dizolvă în apă cu dezvoltare de căldură. În soluție apoasă se produce hidroliza, conform reacției:
SnCl2 + 2H2O = SnO2 + 4HCl
Dioxidul de staniu format rămâne în stare coloidală în soluție. Acidul clorhidric rezultat concomitent se adiționează la clorura stanică neintrată în reacție formând acidul hexaclorostanic:
SnCl4 + 2HCl = H2[SnCl6]
Dintre sărurile acestui acid, hexaclorostanații (IV) sau, pe scurt, clorostanații, MI2[SnCl6], mai important este clorostanatul de amoniu [NH4]2[SnCl6], folosit la imprimeria textilă ca mordant (sarea Pink).
Clorura de staniu (IV) este un acid Lewis puternic. Ea este întrebuințată pentru îngreunarea mătăsii și ca mordant în industria textilă, ca agent de clorurare, ca fumigen, etc.
Disulfura de staniu, adică
sulfura de staniu (IV) sau
sulfura stanică, SnS
2, se obține prin încălzirea unui amestec de amalgam de staniu sau staniu în foi, cu sulf, în prezență de clorură de amoniu. Se prezintă sub formă de fulgi galben aurii, cristalizați în sistemul hexagonal, insolubili în acid clorhidric și acid azotic. Sub această formă este solubilă în acid clorhidric la cald:
SnS2 + 4HCl = SnCl4 + 2H2S
Sulfura stanică se dizolvă în soluții de sulfuri alcaline, cu care formează combinații complexe, tiostanați (IV) alcalini:
SnS2 + S2- = [SnS3]2-
SnS2 + 2S2- = [SnS4]4-
sau în soluții de hidroxizi alcalini, cu care se formează un amestec de hidroxostanați (IV) și tiostanați (IV):
3SnS2 + 6OH- = 2[SnS3]2- + [Sn(OH)6]2-
Aceste reacții sunt reversibile: prin acidularea soluției unui tiostanat precipită din nou sulfura stanică.