Structura învelișului electronic
Tag-uri
Partajeaza in Google Classroom
Transcript
această lecție vom continua să
vorbim despre structura atomului
mai presus vom vorbi despre structura
învelișului său electroni mama
place sunt straturile substraturile
și orbitalii care formează aceste
înveliș știm deja din lecțiile
trecute că atomul e format dintre
un înveliș electronic Unde se găsesc
electronii care au sarcina negativă
și dintre un nucleu Unde se găsesc
protonii care au sarcină pozitivă
și neutroni care au sarcina 0 timpului
au existat foarte mult cu privire
la structura atomului dar în special
învelișul electronic că a dat multe
bătăi de cap oamenilor de știință
aceste teorii sau concretizat în
modele atomice unul din primele
modele atomice este cel propus
de Ernest ruter un fizician celebru
care a prezentat atomul cu nucleul
în centru și cu electroni care
se rotesc în jurul său însă acest
model nu ai Explicați și stabilitatea
tu Niels bohr a Apropo sunt model
Atomic în care electronii se rotesc
în jurul nucleului pe traiectorii
bine definite pe care le a denumit
orbite ceea ce asigură stabilitatea
atomului Sunt convinsă că acest
model vă este familiar chiar dacă
a fost infirmat modelul se mai
folosește și astăzi pentru a ne
ajuta asa vizualizări O primă fază
faptul că electronii nu stau locului
ei nu au poziție fixă în timp și
spațiu și se mișcă continuu în
jurul nucleului schrodinger un
alt fizician celebru a elaborat
în 1930 un nou model atomic ce
nu a fost încă infirma în modelul
atomic al lui schrodinger noțiunea
de orbită din modelul lui bohr
a fost înlocuită cu de orbitali
schrodinger explicat că orbitalul
este o zonă din jurul nucleului
în care electronul se găsește cu
cea mai mare probabilitate Spre
exemplu atomul de acesta are un
singur electron în învelișul său
electronic conform modelului Atomic
al lui schrodinger acestor electron
are 90% probabilitate să se găsească
în primul strat energetic din jurul
nucleului putem găsi aici pe aici
sau aici dar în mai putem găsi
chiar și aici doar că probabilitatea
este mult mai mică poziția unui
electron în spațiu este descrisă
deci de o functie de probabilitate
Așadar conform acestui model atomic
un orbitali este zona din jurul
nucleului Unde putem găsi electronul
cu probabilitate marți învelișul
electronic al unui atom poate fi
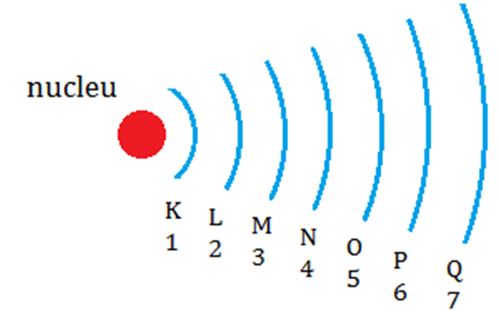
structurat în straturi de electroni
care sunt zone difuze situate la
distanțe diferite de nucleu straturile
de electroni sunt notate cu litere
de la a la q e l m n o p sau cu
cifre de la 1 la 7 Deci intru în
atom sunt ocupate cu electroni
număr de straturi unde n poate
fi orice cifră de la unul Așa numărul
maxim de electroni care se găsesc
în fiecare strat este dat de următoarea
regulă valabilă pentru n mai mic
sau egal cu 4 un strat n poate
fi ocupat de maximum 2 ori n la
puterea a doua electroni Deci fiecare
strat conține unul sau mai multe
substratul iar substraturile la
rândul lor conțin orbitali substraturile
din contrat se deosebesc între
ele prin nivelul de energie și
prin numărul maxim de electroni
pe care îi pot conține bun după
cum am mai spus și mai devreme
orbitalul unde scrie un traseu
fix ale electronului și probabilitatea
maximă ca acele electron Să se
afle întru anumită zonă la o anumită
distanță de nucleu la un moment
dat există patru tipuri de orbitali
și anume orbitali de tip s de tipar
de Și orbitali de tip s după nivelul
de energie caracteristic orbitali
se ordonează chiar în acest fel
substraturile sunt formate din
orbitali de același tip și au aceeași
energie exemplu primul strat ca
are un singur substrat de numit
unul e al doilea strat al are două
substantive și 2 pe al treilea
strat energetic m are trei substratul
3S 3p și 3D al patrulea Astra at
An are 4 subtitrat U4 S4 pe 44s
al cincilea strat energetic are
tot patru substraturi și anume
5s 5c 5 5s și tot așa pe lângă
faptul că sunt în mișcare continuă
jurul nucleului electronii execută
și o mișcare în jurul propriei
axe așa cum Pământul se rotește
în jurul axei sale această mișcare
a electronilor în jurul propriei
axe se numește mișcare de spin
și să face în două sensuri opuse
orbital poate fi ocupat de maximum
2 electroni care se rotesc în jurul
axei lor în sensuri opuse Adică
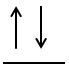
care au aceasta este reprezentarea
simbolică a unui orbital complet
ocupat cu cei doi electroni de
spin opus tot simbolică un orbital
complet ocupat se reprezintă și
astfel mai pe scurt fiecare tip
de orbitali are o anumită formă
geometrică dar are energii diferite
în funcție de substratul în care
se găsește orbitali de tip s au
formă sferică și pot fi ocupat
de maximum 2 electroni în substratul
iile es se găsește un singur orbitali
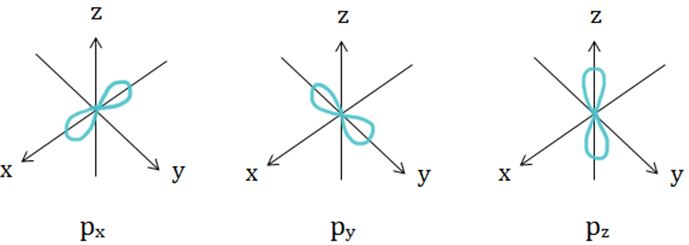
S orbitali de tip p au forma A2
loc simetrici cu orienta care e
precisă spațiu un substrat p format
din trei orbitali de tip p și anume
pe x pe y și pe z orientat după
una din cele trei direcții ale
axelor de coordonate x y se auzi
Deci putem reprezenta în acest
fel orbitalul pe X sau orbitalul
pe Y8 este orbitalul pentru un
substrat pe pot intra maxim șase
electroni câte doi pe fiecare orbitali
de tip p în fiecare strat orbitalul
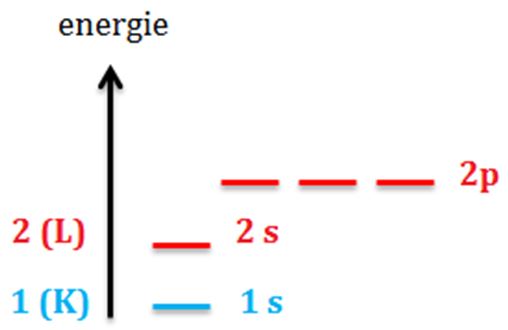
s este situat la un nivel energetică
inferior celui la care sunt orbitalii
prezent aici ca acest energie acesta
este în care crește energia în
primul strat ca avem substratul
1s în care se găsește un singur
orbital esti în al doilea strat
avem substratul 2s cu un orbitali
s și substratul 2p cu cei trei
orbitali de tip p vedem din diagramă
energetică energia substratului
12 este mai mare decât energia
substratului doi orbitali de tip
de a formei mult mai complicate
putem vedea în această imagine
pe fiecare substrat de există 5
orbitali d care pot fi ocupat cu
maximum de selectron pentru că
știind că fiecare orbitali se poate
ocupa cu doi electroni Deci doi
electroni ori 5 orbitali d egal
cu 10 electroni ce intră în final
orbitali de tip s aceștia au forme
și mai complicate Deci mult mai
greu de redat un substrat s conține
șapte orbitali de tip care pot
primi maxim un 14 Electro în continuare
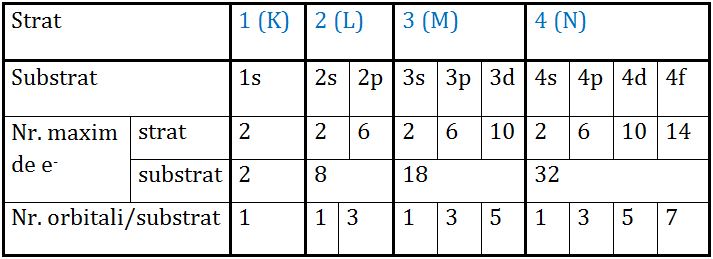
am pregătit aici în tabel ca să
rezumăm împreună datele privind
structura învelișului de electroni
vorba despre structura învelișului
de electroni al unui atom care
are patru straturi ocupate cu electroni
avem de stratul cu numărul 1 cum
a spus și mai devreme stratul cu
numărul 1 are un singur substrat
1s acesta conține un singur orbitali
S iar numărul maxim de electroni
atât este de 2 electroni stratul
2 are două subtitrat 2s și 2 este
un singur orbital ace iar în substratul
2p sunt trei orbitali de tip p
numărul maxim de electroni în substratul
2 este 2 iar un cazul substratului
2 pe este 6 electroni iar totalul
de electroni din stratul cu numărul
2 este de 8 în stratul 3 Avem 3
subtitrat 3S 3p și 3D în substratul
3S este un singur orbitali S substratul
3p conține 3 orbitali p iar substratul
3D conține cinci orbitali de tip
de Deci maximul de electroni în
substratul este unul doi doi trei
ori doi șase și cinci ori doi zece
Electro în total avem un număr
maxim de 18 electroni pe stratul
cu numărul 3 și intratul cu numărul
4 care are patru substratul 4 S4
pe 44 numărul de orbitali din fiecare
substrat este un orbital a trei
orbitali P 5 orbitali d și 7 orbitali
de tip s iar numărul maxim de electroni
în acestă substraturi este unul
ori doi doi trei ori doi șase cinci
orbitali de aur 2 electronice electronice
7 orbitali s are doi electroni
14 electroni în total în stratul
cu numărul 4 vom avea un număr
maxim de 32 de electroni Ce putem
face noi cu toate acestea informații
orbitalii și straturile și substraturile
sunt foarte important pentru a
determina configurația electronică
a elementelor chimice adică pentru
a știi fiecare electron Unde se
găsește cu probabilitatea cea mai
mare asta ne va ajuta să înțelegem
mai departe proprietățile elementelor
și mai ales în felul în care acestea
reacționează Așadar vom continua
colecție despre configurația electronică

 4: un strat de electroni poate fi ocupat de maxim 2 x n2 e-.
4: un strat de electroni poate fi ocupat de maxim 2 x n2 e-.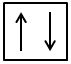 sau
sau