Configurația electronică a elementelor din primele 3 perioade (Z 1-18)
Partajeaza in Google Classroom
Transcript
după cum am mai precizat până acum
ce faci tot foarte mult în lecțiile
viitoare să înțelegem Ce se întâmplă
cu electroni din învelișul electronic
adică să cunoaștem configurația
electronică a unui atom deja știm
că electroni unui atom se află
în nivelul energetice specifice
adică în stratul pe care le putem
numerota cu cifre 1 2 3 4 sau cu
litere k l m n 4 straturi se găsesc
la diferite distanței față de nucleu
cu cât e mai mare numărul nivelului
energetic poate fi mai departe
de nucleu și în general cu atât
mai mult crește și energia de care
are nevoie electronul pentru a
se afla acolo de electroni caută
să se afle pe nivelul energetic
cel mai scăzut pus această distribuția
electronilor în straturi substraturi
și orbitali care formează învelișul
electronic al atomului se numește
configurație electronică însă distribuția
electronilor tine cont de anumite
reguli de știință au străbat că
electroni respectă anumite comportamente
așa că le au renunțat sub formă
de principiu făcând lucrurile mai
ușoare pentru primul principiu
de care trebuie să ținem cont atunci
când vorbim despre configurații
electronice acela al stabilității
sau al minimei energii principiul
stabilității spune că electronii
preferă să ocupi în niveluri de
energie cât mai joase adică acelea
unde cheltuiala lor de cât mai
mică astfel că orbitali sunt ocupați
în ordinea creșterii energiei doar
să ne reamintim că orbitalii s
sau cea mai joasă energie iar orbita
e cea mai înaltă energie al doilea
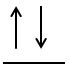
principiu este principiul lui Pauli
sau principiul de excluziune care
spune că fiecare orbitala lumea
tu poate fi ocupat cu maximum 2
electroni de spin opus iar regula
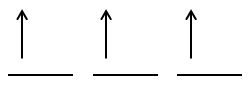
lui hund se referă la faptul că
orbitali primesc câte un electron
cu același adică cu spin paralel
și numai după ce tot ce orbitalii
substratului sunt astfel ocupați
cu câte un electron se trece la
completarea cu cel de al doilea
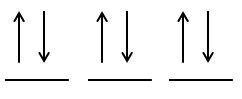
electron de spin opus să luăm de
exemplu substratul 2 pe 3 știind
că are trei orbitali de tip p completarea
substratului 2 pe în cazul unui
atom care are acest substrat complet
ocupat se face în acest fel mai
întâi se ocupă cu electronii de
spin paralel și abia apoi se realizează
cu electronul destino pus în continuare
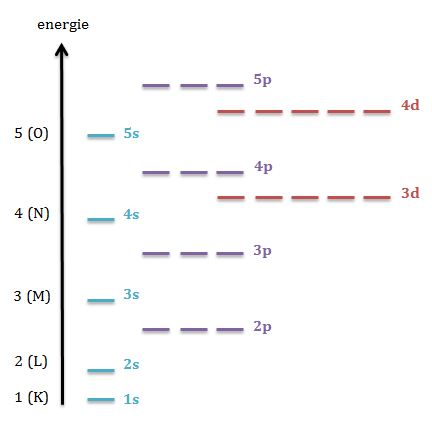
Haideți analizăm diagrama nivelurilor
de energie care ne poate ajuta
să completăm corect configurația
electronică a oricăruia asta ținând
cont de principiul celălalt minim
energiei reprezentată În diagrama
orbitalii cu linii pe care pot
fi Plasați electronii 2 pe fiecare
orbitali pe prezentarea e făcută
în funcție de nivelul de energie
al fiecărui orbitali orbitalul
1s este cel mai apropiat de nucleu
și are cea mai joasă energie este
de asemenea singurul orbital nivelul
de energie 1 sau ca în nivelul
de energie 2 sunt atât orbital
de tip cod și pe cu orbitalul 2s
având energie mai joasă decât orbitalii
doi cei trei orbitali din substratul
2p sunt Reprezentați prin 3 aceeași
energie este comună și reprezentarea
prin căsuțe dar aici asa pe aceasta
cu linii fiind un pic mai simplu
de asemenea am reprezentat și nivelurile
mergeti si 3 4 și 5 bancă orbitali
s are o energie mai joasă decât
orbitalii 3D aceasta eo excepție
de la această diagramă corespunde
cu reprezentarea schematică a straturilor
din învelișul electronic pe care
am folosită și mai devreme Deci
avem stratul cu numărul 1 2 3 4
și 5 Să vedem care este configurația
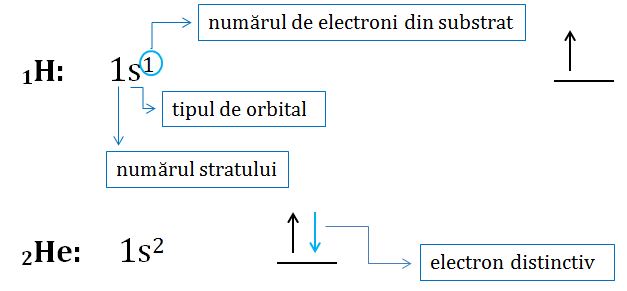
electronică a atomului de hidrogen
atomul de hidrogen a cărui sarcină
electrică este neutralizată de
un singur electron această unică
electro se găsește în orbitalul
1s din stratul k adică stratul
1 pentru că orbitalul unui este
cel mai apropiat de nucleu pe nivelul
cu energia cea mai mică configurația
electronică a atomului se scrie
în acest fel 1 S1 sau se mai poate
reprezenta schematic în această
reprezentare cifra 1 corespunde
numărului stratului sau a nivelului
energetic an litera s corespunde
tipului de orbitali în care se
află electronul iar cifra care
se scrie deasupra literei reprezintă
numărul de electroni din substratul
element este heliul care are doi
electroni în învelișul electronic
configurația electronică este 1
este oi sau reprezentarea schemă
să văd cum e foarte ușor de observat
configurația electronică a atomului
de heliu se deosebește de configurația
hidrogenului numai prin prezența
celui de al doilea electroni se
numește electron distinctiv Deci
electronic al fiecăruia diferă
de învelișul electronic al atomului
precedent numai pentru electroni
distinctivi Așadar învelișul electronic
al următorului element conține
trei Electro acest aliment este
doi dintre ele ocupă orbitalul
unu e al treilea electron nu mai
intră aici deoarece 1s este complet
ocupat este va place tine următorul
orbitali liber respectând principiul
adică acela al Ninei din diagrama
energetică putem vedea că acesta
este un titlul doi orbitali 2s
este tot ferit însă are un volum
mai mare decât talul unor acest
lucru este valabil și Pe măsură
ce trecem la următoarele niveluri
energetice să Reprezentăm configurația
litiului și în acest fel orbitalul
1s complet ocupat și cu orbitalul
2s cu energie ceva mai mare cu
un singur electron acum atomul
de porc cu simbolul pe acesta are
în înveliș cinci electroni configurația
1 S2 2 S2 iar ultimul act RON adică
electronul distinctiv va fi plasat
în orbitalul liber imediat următor
Care este unul dintre cei trei
orbitali de tip p din substratul
2p Deci 2 pe 1 sau mai vedeam reprezenta
configurația și în acest fel orbitalul
1s complet ocupat 2 la fel complet
ocupat și cei trei orbitali pe
din substratul 2p unde avem un
singur electron în cazul atomului
de carbon care are 6 electroni
în învelișul aceea este următoare
1 s22 s22 pe 2 iar în reprezentarea
schematică a valul 1 s complet
ocupat 2 astfel complet ocupat
și haide să vedem acum sunt repartizați
cei doi electroni din substratul
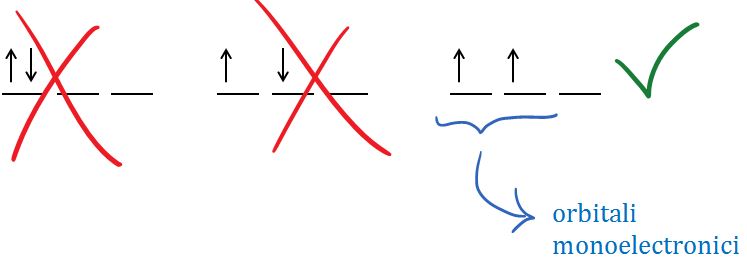
2p Există trei posibilități însă
dacă ne amintim de regula lui știu
că numai una dintre cele trei posibilități
este valabilă și anume aceasta
deoarece conform regulii un dormital
un substrat se ocupă cu cât aur
electroni paralele și abia apoi
are loc cuplarea lor cu electronul
distinctiv aceștia care au câte
Electro se numesc orbitali monoelectronici
mai târziu când vom vorbi despre
chimia organică vom vedea cât de
importanți care pleaca din câte
un orbital datorită lor și a celorlalți
doi electroni din substratul 2-a
carbonul este un element fizică
studiază numai compuși cu carbon
la ora actuală se cunosc aproximativ
16 milioane de compuși organici
încă mulți alții mai pot fi descoperit
dar până atunci Haide să vedem
care configurația electronică a
următoarelor elemente din perioada
carbonului și câți orbitali monoelectronici
au acestea te vor da să știm că
o să întâlnii Așezați în care sunt
orbitalii monoelectronici pentru
casca Explică reactivitatea chimică
a elementelor respective sunt în
tabelul periodic vedem aici eu
perioada a doua Unde se găsește
și carbon 10% oxigenul are șapte
electroni în învelișul sau electronic
iar configurația sa este 1 S2 2
S2 2p 3 și scrii în configurația
și în acest fel Observă mai ușor
orbitali monoelectronici deci azotul
are trei astfel de orbitali genul
are opt electroni iar configurația
electronică este următoarea 1 s22
s22 pe 4 și vedem că oxigenul are
doi orbitali monoelectronici norul
cu un nouă elevi tron are următoarea
configurație 1 doi doi doi pe cinci
orbitali monoelectronici neonul
cu 10 electroni 1 s22 s22 pe 6
observăm Tony anulare orbitalii
de stratul 2 ocupați cu un numărul
maxim de electroni adică 8 structura
de 8 electroni pe ultimul strat
se numește aceasta face ca omul
să fie foarte stabil adică să aibă
o reactivitate foarte foarte redus
Deci elementul neon cu configurația
de octet pe ultimul strat încheie
perioada în cazul elementelor din
perioada a treia începe ocupare
cu electroni a stratului cu numărul
3 primul element din perioada 3
este sodiul și are 11 electroni
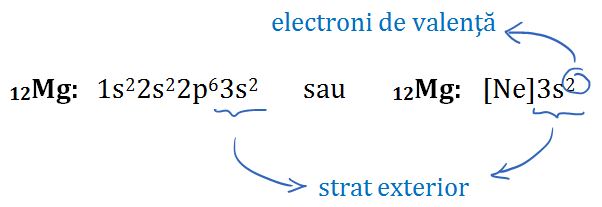
în învelișul ma de magneziu care
are 12 electroni învelișul electronic
configurația electronică a sodiului
este următoarea 1 s22 s22 pe 6
iar electronul distinctiv intră
în orbitalul 3S din stratul cu
numărul 3 configurația soțului
este identică cu cea a neon Deci
mai putem scrie configurația electronică
a sodiului în acest fel neon între
paranteze pătrate trei iezi 1 la
fel în cazul magneziului neon 3
S2 acesta este stratul exterior
electronii din stratul exterior
se numesc electroni de valență
a determina proprietățile chimice
ale atomilor deci sunt foarte important
și vor reveni asupra după ce se
ocupă substratul 3S urmează completarea
substratului vrei pe până la argon
care la fel ca neonul are configurație
stabilă de octet pe ultimul strat
1 S2 2 S2 2p 6 3S 2 3 pe 6 sau
configurația argonului mai poate
fi scris în acest fel configurația
neonului trăiesc 2 3 pe 6 organul
se încheie perioada a treia a tabelului
periodic în lecția viitoare vom
discuta despre configurația învelișului
electronic a elementelor din perioada
a patra adică a elementelor cu
numărul atomic z mai mare decât
18

 sau
sau