Carbonul este unul dintre elementele cele mai răspândite în natură, deși formează numai 0,35% din scoarța pământului. El este o componentă atât a lumii minerale, cât și a lumii organice.
În lumea minerală, carbonul apare îndeosebi sub formă de carbonați, mai ales piatră de var și marmură, CaCO3, magnezit, MgCO3, dolomit, MgCO3 · CaCO3; mult răpândiți sunt și carbonații metalelor grele, ca de exemplu sideroza, FeCO3.
În aerul atmosferic, carbonul se găsește sub formă de dioxid de carbon, CO2, însă în concentrații mici (în medie 0,03%).
Importanța cea mai mare o are însă carbonul în lumea organică; nu există organism vegetal sau animal care să nu conțină carbon; țițeiul și gazele naturale, ozocherita și chihlimbarul, grăsimile și zahărul, amidonul și celuloza, precum și multe alte substanțe conțin în molecula lor elementul carbon.
Carbonul se găsește în natură și în stare elementară, și anume sub formă de cărbuni de pământ, grafit și diamant.
Cărbunii de pământ (cărbunii fosili) sunt produsele de descompunere - bogate în carbon - ale substanțelor organice, mai exact ale substanțelor lemnoase din plante.
Procesul formării cărbunilor fosili este următorul:
În decursul secolelor, scoarța pământului a suferit diferite transformări. Prin mișcările de straturi, o mare parte din vegetația existentă a fost acoperită de pământ sau de nisip și mâl adus de ape, fiind astfel izolată de aer. În aceste condiții. Întâi sub influența unor microorganisme, iar apoi sub influența presiunii straturilor de pământ și a temperaturilor înalte, substanța lemnoasă a suferit procese complicate; substanțele volatile rezultate, de exemplu CO2 și H2O, s-au eliminat parțial; concomitent substanța lemnoasă s-a îmbogățit în carbon, transformându-se astfel în cărbuni. Acest proces lent de transformare a substanței lemnoase în cărbuni se numește încarbonizare. Cu cât încarbonizarea s-a desfășurat într-un interval de timp mai lung, cu atât cărbunii rezultați sunt mai bogați în carbon.
După natura substanței din care a luat naștere cărbunele și în funcție de temperatură, presiune și timp, s-a format o varietate mare de cărbuni.
Din punctul de vedere al vârstei, cărbunii se pot clasifica în: antracit, huilă, cărbune brun, lignit și turbă.
- Antracitul este cărbunele cel mai vechi și cu cel mai mare conținut în carbon (94-97%). Are strălucire metalică, culoare neagră (irizații) și este compact. Arde mai greu, cu flacără scurtă, fără fum, deoarece dezvoltă puține gaze; prin ardere dezvoltă multă căldură (circa 8700 kcal/kg), din care cauză este de mare valoare termică.
- Huila, sau cărbunele de pământ are o strălucire unsuroasă, culoare neagră și pe hârtie lasă o urmă cenușie-neagră. Conținutul în carbon este de 75-94%. Sunt diferite calități de huile: huilă grasă, care arde cu flacără luminoasă fără fum și se folosea pentru obținerea gazului de iluminat, și huila slabă, care arde cu flacără fără fum, este greu de aprins și se folosește numai pentru încălzire directă. Are o putere calorifică de 7600-8700 kcal/kg.
- Cărbunele brun este un cărbune de culoare brună, cu aspect câteodată lucios. Arde cu flacără lungă. Conținutul în carbon este de 65-76%. Puterea lui calorifică este de 6200-7600 kcal/kg.
- Lignitul este o varietate de cărbune brun, cu structură foarte variată după locul de formare. Conținutul în carbon este de 65-70%. Arde cu flacără cu fum. Puterea calorifică variază între 6200 și 6700 kcal/kg.
- Turba reprezintă starea cea mai nouă de încarbonizare, în care se observă chiar adeseori urmele plantelor din care provine. Conținutul de carbon este de 49-60%. Este de culoare cafenie, cu aspect buretos; arde încet cu fum dens și miros neplăcut. Cantitatea de apă din turbă este foarte mare (70-80%); de aceea trebuie uscată înainte de utilizare. Puterea calorifică este de 5000-5800 kcal/kg.
Zăcămintele de cărbuni se găsesc pe tot globul. Țări bogate în cărbuni superiori sunt: Rusia, SUA, Anglia, Belgia, Germania, China. Valorificarea cărbunilor extrași se face în funcție de calitățile naturale ale acestora. Antracitul se utilizează ca reducător în industria metalurgică și pentru confecționarea electrozilor; huila de calitate superioară - pentru fabricarea cocsului. O parte din huilele din Valea Jiului, cărbunele brun și lignitul au fost folosiți drept combustibili pentru termocentrale și alte scopuri energetice. Turba era folosită drept combustibil casnic.
Diamantul se găsește în pământ, răspândit în puține locuri pe glob. Cele mai importante zăcăminte sunt mai ales în Congo, în sudul Africii, în SIberia, India, Brazilia.
Masa diamantului se exprimă în carate, un carat având 0,205 g. Cel mai mare diamant găsit până astăzi este diamantul
Cullinan care are 3106 carate, și a fost descoperit în Africa de Sud în 1905.
În ultimele decenii s-a reușit obținerea pe cale artificială a unor diamante cu mase până la 0,05 g, încălzind mai multe ore grafit la 2000°C, sub o presiune de 100 000 kgf/cm2.
Diamantul este cristalizat în sistemul cubic cu fețe centrate. În rețeaua diamantului, atomii de carbon sunt astfel așezați, încât fiecare atom este înconjurat tetraedric la distanțe egale, de alți atomi de carbon, (după cum se vede în figura de mai jos), fiecare dintre cei patru electroni de valență formând o legătură covalentă cu câte un atom vecin. Structura diamantului este deci aceea a unui cristal atomic sau a unei molecule uriașe. Din această cauză diamantul este atât de dur, are punct de topire foarte ridicat și este insolubil în dizolvanți.
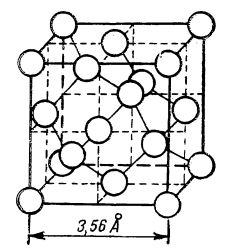 Rețeaua cristalină a diamantului
Rețeaua cristalină a diamantuluiDiamantul are densitatea 3,51. El are cea mai mare duritate dintre toate substanțele (duritate 10). De obicei, diamantul este fără culoare; rareori este colorat în negru, galben sau albastru. Este rău conducător de căldură și electricitate. Spre deosebire de sticlă, este transparent pentru razele X (așa poate fi identificat). De asemenea, dispersează energic razele de lumină care îl străbat, având un indice de refracție foarte mare, aceasta fiind și cauza “focurilor” sale. Puterea sclipitoare, jocurile de lumină sau “focurile” diamantului cresc într-un grad mai mare când i se fac fețe artificiale, așezate astfel, ca razele de lumină care pătrund în diamant să sufere o reflexie totală. Așa se obțin briliantele.
Din punct de vedere chimic diamantul este foarte rezistent; nu este atacat nici de acizi, nici de baze. Încălzit la peste 800°C arde în oxigen curat, trecând în dioxid de carbon; încălzit în absență de aer, se transformă în grafit.
Diamantul este utilizat pentru găurirea și șlefuirea materialelor foarte dure, la tăiatul sticlei, la confecționarea unor lagăre speciale, a instrumentelor de precizie și la calibrarea sârmei; 5% din cantitatea totală de diamante se utilizează la confecționarea bijuteriilor.
Grafitul este mult mai răspândit în natură decât diamantul. El formează de asemenea zăcăminte, dintre care cele mai importante sunt în Ceylon, Madagascar, Rusia (Siberia), Noua Zeelandă, etc.
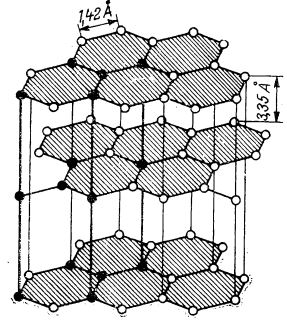
Grafitul cristalizează în sistemul hexagonal, atomii lui fiind așezați în plane paralele și distribuiți în forme de hexagon regulat, cu muchia de 1,42 Å. În același plan, atomii sunt legați puternic prin covalențe. Între plane însă, distanța este de 3,35 Å. Planele sunt deplasate astfel, încât un atom de carbon dintr-un plan este așezat în direcția centrului hexagonului planului următor. Planele sunt legate între ele prin forțe de atracție foarte slabe (forțe van der Waals). Din această cauză, grafitul clivează (se desface în foi) și are duritate mică. Prin urmare, spre deosebire de diamant, în care atomul de carbon manifestă patru valențe îndreptate în cele patru colțuri ale unui tetraedru, la grafit, valențele carbonului sunt îndreptate în special în cele trei direcții din același plan (figura de mai jos).
Rețeaua cristalină a grafitului
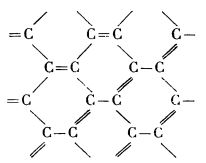
Întrucât în același plan, distanțele interatomice carbon-carbon sunt la grafit de 1,42 Å, deci între distanța unei legături simple (1,504 Å) și distanța unei duble legături (1,33 Å), L. Pauling considera că toate cele patru valențe ale fiecărui atom de carbon sunt folosite să formeze legături cu trei atomi de carbon vecini; ca urmare a unei rezonanțe între diferite structuri de legături de tipul celei din imaginea de mai jos, fiecare legătură carbon-carbon capătă un caracter de o treime dublă legătură.
Datorită celui de-al patrulea electron, mai mobil, se explică și proprietățile de bun conducător termic și electric ale grafitului, precum și opacitatea lui.
Grafitul diferă mult de diamant. El are densitatea 2,1 - 2,3, este opac, de culoare neagră-cenușie și foarte moale (are duritatea 1). Pe hîrtie lasă o urmă cenușie; este unsuros la pipăit. Luciul lui se aseamănă cu al oțelului. Spre deosebire de diamant, este un bun conducător de electricitate și de căldură.
Din punct de vedere chimic este mai reactiv decât diamantul. Prin arderea grafitului în oxigen (la peste 690°C) se obține dioxid de carbon. Căldura de ardere a grafitului este mai mică decât a diamantului (94,04 kcal, față de 94,99 kcal), ceea ce dovedește că este modificația mai stabilă a carbonului.
Grafitul are mare aplicație la fabricarea minelor de creioane (a căror tărie se modifică prin adăugare de argilă), la confecționarea creuzetelor pentru metalurgie (care suportă variații de temperatură), la fabricarea electrozilor (fiind rezistent față de acțiunea substanțelor chimice, mai ales față de clor), apoi la acoperirea tiparelor în galvanoplastie (și datorită conductibilității lui electrice), la fabricarea periilor colectoare la dinamurile electrice, a granulelor din microfoanele telefonice, ca lubrifiant pentru mașini (deoarece în stare coloidală, adăugat la uleiuri, ameliorează acțiunea lor de ungere) etc.
Carbonul negru era considerat înainte carbon amorf; în realitate are însă o structură foarte fină (microcristalină), asemănătoare grafitului. Studii cu raze X au arătat că dimensiunile cristalelor variază între 20 și 40 Å.
Proprietățile carbonului negru sunt condiționate de suprafața foarte mare a cristalelor sale. Datorită suprafeței totale mari, forțele de atracție se manifestă intens; puterea de adsorbție și acțiune catalitică sunt accentuate. De aceea este important ca dimensiunile cristalelor să fie cât mai mici și acestea să nu fie aglomerate între ele.
Carbonul negru se separă când unele produse organice sunt încălzite la temperatură înaltă, în absența aerului. De obicei este numit numai cărbune. El nu se dizolvă în dizolvanți obișnuiți, dar este dizolvat de multe metale topite, ca de exemplu de fier; prin răcire se separă sub formă de grafit.
Cum niciodată nu se obține în stare pură, proprietățile cărbunelui sunt influențate de materia primă, precum și de modul de preparare. De aceea se deosebesc diferite varietăți de cărbune: cărbunele de lemn, cocsul, negrul de fum, cărbunele animal, etc.
Cărbunele de lemn, numit și
mangal, se obține prin încălzirea lemnului în lipsă de aer, ceea ce se face fie prin arderea înăbușită a lemnului, fie prin distilare uscată în retorte de oțel.
Prin arderea înăbușită, care se face în bocșe, lemnul pierde produsele volatile și rămân carbonul și cenușa.
Cum multe dintre componentele volatile ale lemnului sunt însă produse chimice de valoare, astăzi se preferă distilarea uscată a lemnului în instalații speciale; produsele volatile sunt captate și separate, iar în retorte rămâne cărbunele de lemn (mangalul). Produsele obținute prin distilare sunt: acetonă, alcool metilic, acid acetic, gudroane.
Procesul de carbonizare are loc treptat, și anume: până la 200°C distilă apa din lemn, până la 280°C distilă gazele cu conținut de oxigen ca: dioxid și oxid de carbon, până la 380°C distilă hidrocarburile, acidul acetic, alcoolul metilic și gudroanele ușoare. La această temperatură, practic, distilarea se oprește.
Mangalul este un produs de culoare neagră, poros și fragil, la care se mai recunoaște structura lemnului. Aprins (la circa 300°C), arde fără flacără și fără fum. Spre deosebire de cocs, mangalul nu conține sulf.
În afară de întrebuințarea lui drept combustibil, mangalul se întrebuințează în cantități mari în metalurgie, la fabricarea fontei, a oțelului, la rafinarea cuprului, la reducerea oxizilor, la fabricarea carbidului (în amestec de cocs și var), pentru fabricarea pulberii negre explozive, drept adsorbant și în filtrele pentru curățirea apei.
Cocsul este reziduul care rămâne în urma încălzirii antracitului sau huilei în absență de aer, după ce au fost îndepărtate produsele de distilare care s-au format din cărbune sub influența temperaturii înalte, printr-o așa-numită descompunere pirogenă. Procesul se numește
cocsificare; el are loc la temperaturi de circa 1000°C.
Pe măsura încălzirii huilei, peste 100°C distilă apa; peste 200°C, combinații ale carbonului cu hidrogenul (hidrocarburi); peste 270°C, oxizii de carbon; la 280°C începe separarea gudroanelor și cu aceasta începe și descompunerea cărbunelui; până la 600°C distilă componentele volatile din cărbune, iar el rămâne poros. Cantitatea și natura produselor de distilare nu depind atât de tipul cărbunelui, cât de condițiile de distilare.
Produsele de distilare ale huilei sunt toate întrebuințate. Astfel, gazele folosesc la încălzit și iluminat (gazul de iluminat); apele amoniacale rezultate prin dizolvarea în apă a amoniacului, format din azotul conținut în cărbuni, servesc la prepararea sărurilor de amoniu; din gudroane supuse unor rectificări se obțin benzen, toluen, antracen, diferite uleiuri și smoală - produse importante pentru industria coloranților, explozivilor și medicamentelor.
După calitatea huilei folosite se obțin, în funcție de scopul urmărit (adică cocs sau gaz de iluminat), cocsul metalurgic și cocsul de gaz. Cocsul metalurgic este dur, conține circa 90% carbon, arde cu flacără scurtă și are o putere calorifică de 7000-8000 kcal/kg; este folosit acolo unde este necesară o mare dezvoltare de căldură: la elaborarea fontei în furnale, în industria varului, a cimentului, etc. Cocsul de gaz este mai poros, prin ardere lasă mai multă cenușă și are o putere calorifică până la 6500 kcal/kg; este folosit drept combustibil, la fabricarea carbidului și a gazului de apă.
Cărbunele de retortă se formează la temperaturi peste 1500°C, în partea de sus, mai răcită, a retortelor sau camerelor de combustie ale cocseriilor. El are duritate mare, este rezistent față de agenții chimici și bun conducător de electricitate. Deoarece se aseamănă foarte mult cu grafitul, este numit și
grafit de retortă. Este utilizat la fabricarea electrozilor, a cărbunilor din lămpile cu arc electric, la bateriile electrice Leclanché, etc.
Negrul de fum (sau funinginea) este cărbunele obținut prin arderea incompletă a unor substanțe organice cu mare conținut de carbon, de exemplu, rășini, petrol, naftalină, acetilenă, dar mai ales gaz metan. El este folosit la fabricarea cernelii de tipar, a tușului, la confecționarea creioanelor de desen, la fabricarea articolelor de cauciuc, a ebonitei negre (pentru plăci de patefon) etc.
Cărbunele de oase se prepară prin calcinarea în retorte a oaselor degresate. El are un conținut ridicat de săruri minerale, mai ales de fosfat de calciu; de aceea lasă multă cenușă. Fiind cărbune poros, este folosit pentru puterea lui adsorbantă.
Cărbunele animal este cărbunele obținut prin calcinarea sângelui și a resturilor animale, împreună cu carbonat de potasiu. Este un cărbune medicinal.
Proprietățile carbonului negru
Toate varietățile de carbon negru: cărbunele de lemn, cocsul, negrul de fum, cărbunele de oase, cărbunele animal, deși se deosebesc de grafit numai prin mărimea cristalelor, au totuși o comportare diferită. Astfel, carbonul negru are o densitate mai mică decât grafitul. Oxigenul îl oxidează la 200°C la dioxid de carbon. De asemenea, el are putere reducătoare; dacă se încălzește un amestec de oxid de cupru (II) cu cărbune, oxidul de cupru este redus la cupru și se dezvoltă oxizi de carbon:
CuO + O = Cu + CO
2CuO + C = 2Cu + CO2
Carbonul negru are o structură poroasă. Din cauza suprafeței mari care rezultă datorită porilor, are putere de adsorbție. El poate adsorbi diferite gaze, de exemplu clorul. Cea mai bună capacitate de adsorbție manifestă cărbunii obținuți din lemn.
Cărbunele activ
Puterea de adsorbție a unui cărbune poate fi mărită prin anumite tratamente, ca de exemplu încălzirea cărbunilor la temperaturi înalte (800-1200°C) cu vapori de apă, sau, uneori, cu oxigen sau dioxid de carbon. Prin aceasta, numărul porilor cărbunelui se mărește și ca urmare se mărește și suprafața totală a cărbunelui. Cărbunele astfel preparat se numește
cărbune activ. Un gram de cărbune activ poate avea o suprafață de 300-1000 m
2, din care cauză poate adsorbi cantități foarte mari de substanțe. De exemplu, 1 g de cărbune activ poate adsorbi 234 ml clor, la 15°C.
Puterea de adsorbție variază și cu natura substanței adsorbite. În general, cu cât un gaz are punctul de fierbere mai înalt, cu atât poate fi mai ușor adsorbit, după cum se poate observa din exemplele date în tabelul de mai jos:
| Gazul |
SO2 |
Cl2 |
NH3 |
H2S |
CO2 |
CO |
O2 |
N2 |
Gaz adsorbit de 1 g cărbune la 15°C, ml
Punct de fierbere, °C |
380
-10,1 |
234
-34,1 |
181
-33,4 |
98,9
-61,8 |
47,6
-78,5 |
9,3
-190 |
8,2
-183 |
8,0
-195,8 |
Cantitatea de substanță adsorbită variază și cu presiunea gazului (respectiv concentrația, la substanțe dizolvate).
Adsorbția pe cărbune este foarte mult folosită în practică pentru decolorarea unor substanțe (de exemplu siropul de zahăr), pentru purificarea apelor potabile, pentru captarea substanțelor volatile din amestecuri (de exemplu, separare de hidrocarburi) etc. Astfel, dacă într-o eprubetă cu apă slab colorată (cu cerneală, vin roșu, indigo) se introduce o cantitate mică de cărbune activ și se agită, apa se decolorează. Tot apa, dacă într-o eprubetă se agită energic o soluție diluată de amoniac sau de apă de hidrogen sulfurat, cu puțin cărbune activ, mirosul dispare.
Îndepărtarea substanțelor adsorbite de cărbune (desorbția) se face trecând un curent de abur, sub presiune, prin cărbune. Acesta se usucă apoi și astfel, regenerat, poate fi folosit din nou.
Proprietatea cărbunelui activ de a adsorbi gaze toxice, cum este clorul, și a lăsa să treacă aproape total oxigenul și azotul este aplicată la fabricarea măștilor contra gazelor.
Carbonul este relativ rezistent din punct de vedere chimic; reactivitatea lui depinde mult de starea lui de diviziune și de modificația alotropică sub care se găsește.
Carbonul se combină direct numai cu unele elemente. Astfel, se combină cu hidrogenul la temperatura arcului electric și formează hidrocarburi, în special acetilenă. În oxigen arde cu formare de oxizi de carbon; condițiile de oxidare sunt diferite după modificația în care se găsește carbonul (cărbune, grafit, diamant). Cu sulful se combină la cald formând sulfura de carbon, CS2. Cu azotul se combină numai simultan cu hidrogenul formând acidul cianhidric, HCN. Cu metalele formează carburi.
Datorită afinității mari pentru oxigen, carbonul se comportă ca un reducător față de multe alte substanțe compuse. De exemplu, reduce acidul sulfuric concentrat dând un amestec de dioxid de carbon și dioxid de sulf, sau vaporii de apă la temperatură ridicată formând gazul de apă. Datorită proprietății lui de a reduce un mare număr de oxizi metalici, carbonul are o largă întrebuințare în metalurgie pentru obținerea unor metale, în special a fontei.